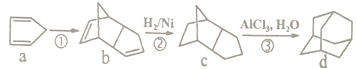
题目内容
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
回答下列问题:

(1)甲装置中仪器a的名称是_____________________。
(2)装置乙中饱和食盐水的作用是_____________________。
(3)①制取漂白粉的化学方程式是______________________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],则产物中还混杂有物质的化学式是______。
③为提高Ca(ClO)2的含量,,可采取的措施是__________________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________(用化学方程式表示)。
(5)家庭中常用84 消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)清洁卫生。两者同时混合使用会产生有毒的氯气,写出该反应的离子方程式________________________________。
(6)实验室用MnO2跟浓盐酸反应时,当盐酸浓度低于8mol/L时就不能生成氯气。某兴趣小组在圆底烧瓶中实际加入了MnO28.7g,20mL36.5%的浓盐酸(密度1.18g/mL),充分反应后最多能够收集到_______L标准状况下的氯气(保留3位有效数字,不考虑反应过程中溶液体积变化)。
【答案】 分液漏斗 除去氯气中混有的氯化氢 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO3)2 将丙装置浸在盛有冷水的水槽中或控制氯气产生速率(其它合理答案也给分) Ca(ClO)2+CO2+H2O=CaCO3+2HClO ClO-+Cl-+2H+=Cl2↑+H2O 0.426
【解析】(1)甲装置中仪器a具有球形特征,有玻璃活塞,在该实验中,可以控制加入的浓盐酸,为分液漏斗。(2)浓盐酸和二氧化锰反应过程中会挥发出氯化氢气体,氯化氢在氯化钠饱和溶液中易溶,而氯气难溶,通过饱和食盐水的作用是除去Cl2中混有的HCl气体。(3)①制取漂白粉的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。②氯气和碱反应会放出热量,导致温度升高,当温度低时,氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;当温度高时,发生了副反应:6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],即还混杂有物质的化学式是Ca(ClO3)2。③温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,或控制氯气产生速率,通过控制反应速率,避免反应放热瞬时温度升高。(4)漂白粉有效成分为次氯酸钙,HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,受空气中的水、CO2作用而导致变质,生成CaCO3和HClO,该反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3+2HClO,所以漂白粉应密封保存。(5)NaClO与盐酸同时混合使用会产生有毒的氯气,该反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O。(6)浓盐酸的浓度是
5CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],即还混杂有物质的化学式是Ca(ClO3)2。③温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,或控制氯气产生速率,通过控制反应速率,避免反应放热瞬时温度升高。(4)漂白粉有效成分为次氯酸钙,HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,受空气中的水、CO2作用而导致变质,生成CaCO3和HClO,该反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3+2HClO,所以漂白粉应密封保存。(5)NaClO与盐酸同时混合使用会产生有毒的氯气,该反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O。(6)浓盐酸的浓度是![]() ,当盐酸浓度低于8mol/L时就不能生成氯气,所以实际参加反应的氯化氢是0.02L×(11.8mol/L-8mol/L)=0.076mol。二氧化锰的物质的量是0.1mol,根据方程式MnO2+4HCl(浓)
,当盐酸浓度低于8mol/L时就不能生成氯气,所以实际参加反应的氯化氢是0.02L×(11.8mol/L-8mol/L)=0.076mol。二氧化锰的物质的量是0.1mol,根据方程式MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知二氧化锰过量,生成氯气的物质的量是0.076mol÷4=0.019mol,在标准状况下的体积是0.019mol×22.4L/mol=0.426L。
MnCl2+Cl2↑+2H2O可知二氧化锰过量,生成氯气的物质的量是0.076mol÷4=0.019mol,在标准状况下的体积是0.019mol×22.4L/mol=0.426L。

【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。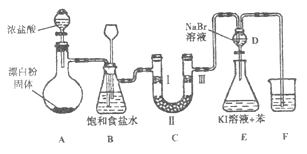
(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:。
(2)装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是(填字母编号)。
编号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 , 该现象(填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是。
(5)装置F的烧杯中的溶液不能选用下列中的(填字母编号)。a.饱和NaOH溶液 b.饱和Ca(OH)2溶液 c.饱和Na2CO3溶液