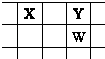题目内容
【题目】一定条件下,Ni2+与丁二酮肟生成鲜红色沉淀A. 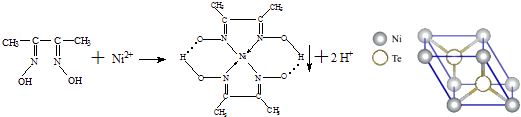
(1)基态Ni2+的核外电子排布式为 .
(2)丁二酮肟组成元素中C,N,O的电负性由大到小的顺序为 .
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 .
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为﹣19.3℃.Ni(CO)4的晶体类型是 .
(5)人们在研究分子结构时发现,CO与N2分子结构非常相似,我们把具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子体”.请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 .
(6)对于A物质: ①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是 , 氮镍之间形成的化学键是;
②该结构中,氧氢之间除共价键外还可存在 .
【答案】
(1)1s22s22p63s23p63d8(或[Ar]3d8)
(2)O>N>C
(3)NiTe2
(4)分子晶体
(5)![]()
(6)σ键、π键;配位键;氢键
【解析】解:(1)镍原子核外电子数是28,镍原子失去最外层2个电子变成基态Ni2+ , 根据构造原理知,基态Ni2+的核外电子排布式为1s22s22p63s23p63d8(或[Ar]3d8),所以答案是:1s22s22p63s23p63d8(或[Ar]3d8);(2)同一周期中,元素的电负性随着原子序数的增大而增大,所以C、N、O三种元素的电负性大小顺序为:O>N>C; 所以答案是:O>N>C;(3)该晶胞中镍原子个数=8× ![]() ,Te原子个数=2,则该晶胞中镍和碲原子个数之比为1:2,则其化学式为:NiTe2 ,
,Te原子个数=2,则该晶胞中镍和碲原子个数之比为1:2,则其化学式为:NiTe2 ,
所以答案是:NiTe2;(4)分子晶体的熔沸点较低,所以该物质为分子晶体;
所以答案是:分子晶体;(5)由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式为 ![]() ;
;
所以答案是: ![]() ;(6)①双键是由一个σ键和一个π键构成,分子中存在C=N,所以碳氮之间的共价键类型是σ键、π键;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键;
;(6)①双键是由一个σ键和一个π键构成,分子中存在C=N,所以碳氮之间的共价键类型是σ键、π键;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键;
所以答案是:σ键、π键;配位键;
②分子中存在﹣OH,﹣OH之间可以形成氢键;
所以答案是:氢键.
【考点精析】本题主要考查了分子晶体的相关知识点,需要掌握分子间的分子间作用力相结合的晶体叫作分子晶体才能正确解答此题.

 阅读快车系列答案
阅读快车系列答案【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。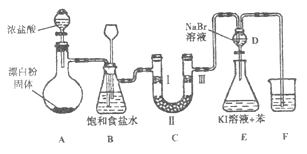
(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:。
(2)装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是(填字母编号)。
编号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 , 该现象(填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是。
(5)装置F的烧杯中的溶液不能选用下列中的(填字母编号)。a.饱和NaOH溶液 b.饱和Ca(OH)2溶液 c.饱和Na2CO3溶液