题目内容
【题目】下如图所示,是原电池的装置图。请回答:
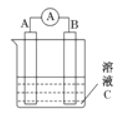
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe,A极材料为铜,A为______极,A电极上发生的电极反应式为___________________________,反应进行一段时间后溶液C的c(H+)将___________(填“变大”“减小”或“基本不变”)。
(2)若C为CuSO4溶液,B电极材料为Zn,A极材料为铜。则B为_________极,B极发生________反应(填“氧化或还原),B电极上发生的电极反应为______________。
【答案】正 2H++2e-=H2↑ 减小 负 氧化 Zn-2e-=Zn2+
【解析】
(1)活泼金属作负极,原电池反应是铁与稀硫酸置换氢气的反应,正极反应是氢离子得电子生成氢气,负极上是金属铁失电子发生氧化反应,据此回答;
(2)若C为CuSO4溶液,B电极材料为Zn,A极材料为铜,原电池反应,B电极为负极,锌失去电子,A电极溶液中铜离子得到电子生成铜。
(1)铁比铜活泼,铁作负极,A极材料为铜,A为正极,则该原电池反应是铁与稀硫酸置换氢气的反应,所以正极反应是氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑;溶液中氢离子放电,导致溶液中c(H+)减小;
(2)若C为CuSO4溶液,B电极材料为Zn,A极材料为铜,锌比铜活泼,B电极为负极,锌失去电子发生氧化反应,电极反应为Zn-2e-=Zn2+。

练习册系列答案
相关题目