题目内容
J、Q、M、R、T是原子序数依次增大的短周期主族元素,J、Q、R在周期表中的相对位置如下表。已知J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。下列说法正确的是
| J | | Q |
| | | R |
A. J和氢元素形成的化合物分子中只含极性共价键
B. R、Q两元素形成的氢化物中,R的氢化物沸点更高
C. J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是H2RO4
D. M单质能与氢氧化钠溶液反应,其中水和氢氧化钠都是氧化剂
D
解析试题分析:J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J是第四主族元素,根据其在周期表中的位置判断,J是C元素;M是地壳中含量最多的金属元素,所以M是Al元素;根据元素周期表的结构判断Q、R、T分别是O、S、Cl元素。A、 C和氢元素形成的化合物分子中既含极性键又含非极性键,错误;B、O、S形成的氢化物中,由于氢键的存在使水的沸点高于硫化氢的沸点,错误;C、J、M、R、T元素中非金属性最强的是Cl元素,所以最高价氧化物对应的水化物中酸性最强的是HClO4,错误;D、Al与氢氧化钠溶液反应,生成偏铝酸钠和氢气,其中水和氢氧化钠都是氧化剂,正确,答案选D。
考点:考查元素推断,元素周期表的应用,元素周期律的应用,元素性质的判断

关于下列图示的说法中正确的是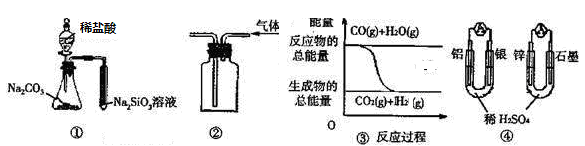
| A.用图 ① 所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
B.用图 ② 所示实验装置排空气法收集CO2气体 | C.图 ③ 表示反应 CO(g)+H2O(g) CO2(g)+H2(g)是放热反应 |
| D.图 ④ 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
下图是元素周期表短周期的一部分,Y、W的质子数之和为25。下列说法正确的是
| | X | | Y |
| Z | | W | |
A.非金属性:W>Z
B.原子半径:X<Y
C.Z的最高价氧化物可溶于Y的氢化物的水溶液
D.Y的最高价氧化的水化物酸性强于W最高价氧化的水化物
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
| A.10Be和9Be是中子数不同质子数相同的不同原子 |
| B.10Be的原子核内中子数比质子数多 |
| C.5.2 g26Al3+中所含的电子数约为1.2×1024 |
| D.26Al和26Mg的质子数、中子数和核外电子数都不相同 |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
下列物质的性质比较,正确的是
| A.酸性:H2SO4>HClO4>HBrO4 | B.碱性:NaOH>KOH>RbOH |
| C.非金属性: P>S>Cl | D.气态氢化物稳定性:HF>H2O>PH3 |
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期。X和Y能形成两种常见共价化合物,Z能与X形成两种常见的离子化合物,阴、阳离子个数比均为1:2。下列说法错误的是
| A.Y、Z、X、W的原子序数依次减小 |
| B.X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| C.由W、X、Y、Z四种元素组成的化合物可能显强酸性 |
| D.W和X形成的化合物,与W和Y形成的化合物中各元素质量比可能相同 |
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超重
元素,该元素原子核内中子数与核外电子数之差是( )
| A.57 | B.47 | C.61 | D.293 |