题目内容
(14分)工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)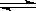 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
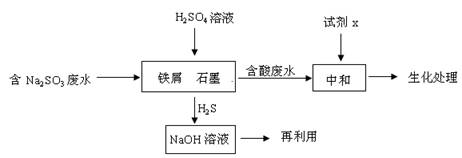
①中和含酸废水工业常用的试剂x是 。
②写出H2S气体与足量NaOH溶液反应的化学方程式 。
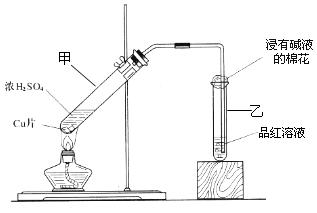
③铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式: 。
④已知:2H2S(g)+O2(g) =" 2" S(s) +2 H2O(l) △H=" —632.8" kJ/mol
SO2 (g) =" S(s)" + O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为 。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因 。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)
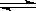 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

①中和含酸废水工业常用的试剂x是 。
②写出H2S气体与足量NaOH溶液反应的化学方程式 。
③铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式: 。
④已知:2H2S(g)+O2(g) =" 2" S(s) +2 H2O(l) △H=" —632.8" kJ/mol
SO2 (g) =" S(s)" + O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为 。
(14分)
(1)①S2—+ H2O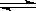 HS— + OH— (2分)
HS— + OH— (2分)
② 1:2 (2分) > (2分)
(2)①石灰水 (2分)
② H2S + 2NaOH = Na2S + 2H2O (2分)
③ SO32—+ 8H+ + 6e—= H2S↑+ 3H2O (2分)
④ 2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l) △H= —1172.4kJ/mol (2分,合理给分)
(1)①S2—+ H2O
 HS— + OH— (2分)
HS— + OH— (2分)② 1:2 (2分) > (2分)
(2)①石灰水 (2分)
② H2S + 2NaOH = Na2S + 2H2O (2分)
③ SO32—+ 8H+ + 6e—= H2S↑+ 3H2O (2分)
④ 2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l) △H= —1172.4kJ/mol (2分,合理给分)
略

练习册系列答案
相关题目
 Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O


 质,正确的方法是
质,正确的方法是