题目内容
15.下列各物质中,化学键类型完全相同的是( )| A. | Na2O2和NaOH | B. | CH3COONa和NaOH | C. | CCl4和H2O | D. | CO2和H2O2 |
分析 一般金属元素与非金属元素形成离子键,非金属性元素之间形成共价键,同种非金属元素之间形成非极性共价键,以此来解答.
解答 解:A.Na2O2中含有非极性键和离子键,NaOH含离子键和极性共价键,不完全相同,故A错误;
B.CH3COONa中含离子键和非极性共价键、极性共价键,NaOH含离子键和极性共价键,不完全相同,故B错误;
C.CCl4和H2O都只含有极性共价键,完全相同,故C正确;
D.CO2只含有极性共价键,H2O2中含有非极性键和极性共价键,不完全相同,故D错误;
故选C.
点评 本题考查化学键,明确化学键判断的一般规律并熟悉特殊情况即可解答,注意铵盐为离子化合物,氯化铝为根据化合物为特例,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.通过实验观察,某气体有下列性质:①有刺激性气味,②可使品红溶液褪色,③溶于水,溶液能使蓝色石蕊试纸变红,④通入浓硝酸中,无红棕色气体产生,据此,该气体可能是( )
| A. | HCl | B. | Cl2 | C. | SO2 | D. | NH3 |
3.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )
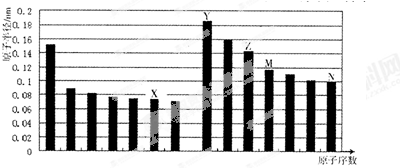

| A. | Z、N两种元素的离子半径相比,前者较大 | |
| B. | 工业上可通过电解熔融的Z 和N组成的化合物来制取Z单质 | |
| C. | 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
10.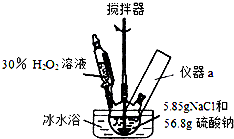 4Na2SO4•2H2O2•NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO3•3H2O2)固体更好,因而具有广泛的应用前景.某小组合成该固体双氧水的实验步骤和装置示意图如下:
4Na2SO4•2H2O2•NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO3•3H2O2)固体更好,因而具有广泛的应用前景.某小组合成该固体双氧水的实验步骤和装置示意图如下:
Ⅰ.合成:往三颈瓶中加入56.8g硫酸钠和5.85gNaCl的固体混合物,开启搅拌器;将稍过量的(约70mL)30%H2O2溶液在20~30min内逐滴分批加入.并控制反应温度15~35℃,加完料后持续搅拌15min,反应结束后过滤,低温干燥得到产品.
Ⅱ.产品稳定性分析:取Ⅰ中所得产品置于干燥器内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol/L酸性高锰酸钾滴定,测定产品中双氧水的含量,以此分析产品的稳定性.所得实验数据如表
已知:a.H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解
b.产品稳定性=(放置一个月后双氧水的质量分数/放置前双氧水的质量分数)×100%
请回答下列问题:
(1)装置图里方框中应添加仪器a,其名称为温度计;写出合成4Na2SO4•2H2O2•NaCl的化学方程式:4Na2SO4+2H2O2+NaCl=4Na2SO4•2H2O2•NaCl.
(2)该合成反应过程中,关键是控制温度,其合理的措施是:ACD
A.逐滴滴加H2O2 B.选用Na2SO4和NaCl固体,而不用其饱和溶液
C.不断搅拌 D.冰水浴
(3)该合成反应过程中30%的H2O2溶液不应大大过量的原因减小产品的溶解损失,提高产率.
(4)4Na2SO4•2H2O2•NaCl固体比过碳酸钠(2Na2CO3•3H2O2)固体更稳定的可能原因是_2Na2CO3•3H2O2中碳酸钠水解呈碱性,而双氧水在碱性条件容易分解.
(5)产品分析实验时,高锰酸钾溶液装于滴定管中,当滴定到达终点时的现象是溶液从无色刚好变为浅红色,且保持30s不褪色.
下列关于该滴定实验过程中的仪器选择和操作都正确的是AC
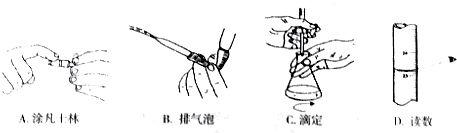
(6)该产品的“产品稳定性”=99.6%.
 4Na2SO4•2H2O2•NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO3•3H2O2)固体更好,因而具有广泛的应用前景.某小组合成该固体双氧水的实验步骤和装置示意图如下:
4Na2SO4•2H2O2•NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO3•3H2O2)固体更好,因而具有广泛的应用前景.某小组合成该固体双氧水的实验步骤和装置示意图如下:Ⅰ.合成:往三颈瓶中加入56.8g硫酸钠和5.85gNaCl的固体混合物,开启搅拌器;将稍过量的(约70mL)30%H2O2溶液在20~30min内逐滴分批加入.并控制反应温度15~35℃,加完料后持续搅拌15min,反应结束后过滤,低温干燥得到产品.
Ⅱ.产品稳定性分析:取Ⅰ中所得产品置于干燥器内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol/L酸性高锰酸钾滴定,测定产品中双氧水的含量,以此分析产品的稳定性.所得实验数据如表
数据 时间 | 样品取用数量(g) | 平均V(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.90 |
b.产品稳定性=(放置一个月后双氧水的质量分数/放置前双氧水的质量分数)×100%
请回答下列问题:
(1)装置图里方框中应添加仪器a,其名称为温度计;写出合成4Na2SO4•2H2O2•NaCl的化学方程式:4Na2SO4+2H2O2+NaCl=4Na2SO4•2H2O2•NaCl.
(2)该合成反应过程中,关键是控制温度,其合理的措施是:ACD
A.逐滴滴加H2O2 B.选用Na2SO4和NaCl固体,而不用其饱和溶液
C.不断搅拌 D.冰水浴
(3)该合成反应过程中30%的H2O2溶液不应大大过量的原因减小产品的溶解损失,提高产率.
(4)4Na2SO4•2H2O2•NaCl固体比过碳酸钠(2Na2CO3•3H2O2)固体更稳定的可能原因是_2Na2CO3•3H2O2中碳酸钠水解呈碱性,而双氧水在碱性条件容易分解.
(5)产品分析实验时,高锰酸钾溶液装于滴定管中,当滴定到达终点时的现象是溶液从无色刚好变为浅红色,且保持30s不褪色.
下列关于该滴定实验过程中的仪器选择和操作都正确的是AC

(6)该产品的“产品稳定性”=99.6%.
20.下列表示有机化合物分子的方法中不正确的是( )
| A. | 3甲基5庚烯: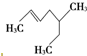 | B. | 异戊烷: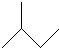 | ||
| C. | 乙酸乙酯:CH3COOCH2CH3 | D. | 甲烷: |
7.分子式为C11H16,含有苯环、-C5H11的有机物的同分异构体有(不考虑立体异构)( )
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
4.水溶液中能大量共存的一组离子是( )
| A. | Na+、NH4+、Cl-、SO42- | B. | Fe2+、H+、SiO32-、ClO- | ||
| C. | Mg2+、K+、OH -、SO42- | D. | K+、Fe3+、NO3-、I- |
5.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理.下列叙述正确的是( )

| A. | 银片为正极,发生的反应为:Ag++e-=Ag | |
| B. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| C. | 取下盐桥,原电池仍可工作 | |
| D. | 在外电路中,电子从正极流向负极 |
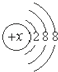 有几种元素的微粒的最外电子层结构如图所示,根据要求回答问题:
有几种元素的微粒的最外电子层结构如图所示,根据要求回答问题: