题目内容
【题目】中科院大连化学物理研究所设计了一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
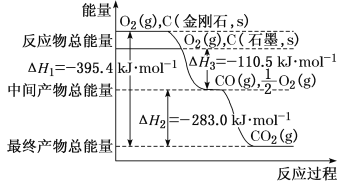
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
则8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) ΔH=___kJ·mol-1。
(2)氨硼烷(NH3BH3)是储氢量最高的材料之一,氨硼烷还可作燃料电池,其工作原理如图1所示。氨硼烷电池工作时正极的电极反应式为__________。
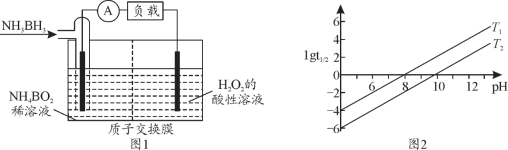
(3)常见含硼的化合物有NaBH4、NaBO2,已知NaBH4溶于水生成NaBO2、H2,写出其化学方程式_______。![]() 为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
为NaBH4反应的半衰期(反应一半所需要的时间,单位为min)。lgt1/2随pH和温度的变化如图2所示,则T1______T2(填“>”或“<”)。
(4)燃油汽车尾气含有大量的NO,在活化后的V2O5催化作用下,氨气将NO还原成N2的一种反应历程如图3所示。
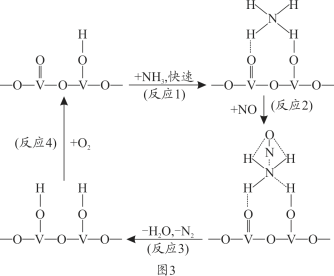
根据图写出总反应的化学方程式_______________。
【答案】-1627 2H++H2O2+2e-=2H2O NaBH4+2H2O=NaBO2+4H2↑ < 4NO+4NH3+O2![]() 4N2+6H2O
4N2+6H2O
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式,即得反应热;
(2)氨硼烷(NH3BH3)电池工作时的总反应为:NH3BH3+3H2O2═NH4BO2+4H2O,左侧NH3BH3为负极、失电子、发生氧化反应,电极反应式为NH3BH3+2H2O-6e-=NH4++BO2-+6H+,右侧H2O2得到电子、发生还原反应,所在电极为正极,电极反应式为3H2O2+6H++6e-=6H2O,据此解答;
(3)NaBH4溶于水生成NaBO2、H2,结合溶液的pH与半衰期的关系判断温度的高低;
(4)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式。
(1)①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
②C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
根据盖斯定律①×![]() -②,整理可得:8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) △H=(-571.6 kJ/mol)×
-②,整理可得:8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) △H=(-571.6 kJ/mol)×![]() -(-5518kJ/mol)=-1627kJ/mol;
-(-5518kJ/mol)=-1627kJ/mol;
(2)氨硼烷(NH3BH3)电池工作时的总反应为:NH3BH3+3H2O2═NH4BO2+4H2O,右侧H2O2得到电子、发生还原反应,所在电极为正极,电极反应式为3H2O2+6H++6e-=6H2O;
(3)NaBH4可水解放出氢气,反应方程式为:NaBH4+2H2O=NaBO2+4H2↑,在酸性条件下,NaBH4不能稳定性存在,NaBH4和酸反应生成硼酸和氢气,反应的离子方程式为:BH4-+H++3H2O=H3BO3+4H2↑。水解反应为吸热反应,升温促进水解,使半衰期缩短,故T1<T2;
(4)用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NO+4NH3+O2![]() 4N2+6H2O。
4N2+6H2O。

【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液时需加入少量铁屑,其目的是__。
(2)甲组同学取2mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__。
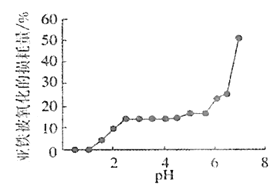
(4)丙组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为__。(写出一条即可)
(5)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:
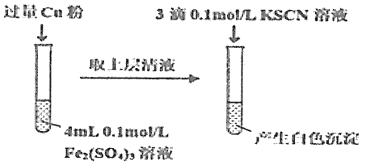
①Fe3+与Cu反应的离子方程式为__。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN的化学性质与I-相似;
ii.2Cu2++4I-=2CuI↓+I2。
填写实验方案:
实验方案 | 现象 |
步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 无明显现象 |
步骤2:取4mL_mol/L的CuSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 产生白色沉淀 |
Cu2+与SCN-反应的离子方程式为__。