题目内容
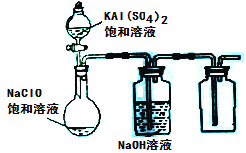
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
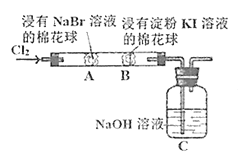
A.A处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.B处棉花球变成蓝色,说明Br2的氧化性比I2强
C.A处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2
D.C装置中与NaOH溶液反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O
【答案】B
【解析】
A.A处发生Cl2+2Br-=2Cl-+Br2,则A处棉花球变成黄色,说明Cl2的氧化性比Br2强,A正确;
B.B处发生Cl2+2Br-=2Cl-+Br2、Br2+2I-=2Br-+I2,只能说明有碘生成,由于氯气的干扰不能说明Br2的氧化性比I2强,B错误;
C.由图可知,A处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2,C正确;
D.C处为尾气处理,装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2=ClO-+Cl-+H2O,D正确;故答案为:B。

 考前必练系列答案
考前必练系列答案【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
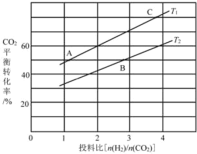
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。
(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%
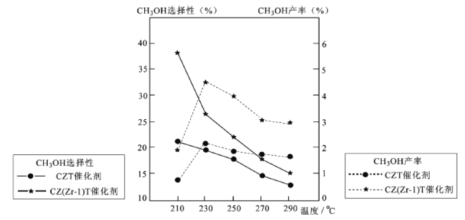
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T