题目内容
(1)
在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)
①该反应的化学平衡常数的表达式K=________,由上表数据可得,该反应为________反应.(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01 mol·L-1、c(H2O)=0.03 mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率________(填“大”、“小”或“不能确定”)
③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为________.
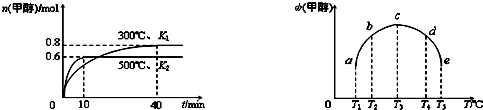
(2)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+
CH3OH(g)+

①平衡时CH3OH的体积分数w为________.
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.下列说法正确的是________

A.2C1>C3
B.x+y=49.0
C.2P2<P3
D.(a1+a3)<1
E.2P1>P3
F.a1=a2
③
在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g)
答案:

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目

 (1)100℃时,该反应的平衡常数:
(1)100℃时,该反应的平衡常数: