题目内容
【选修3-物质结构与性质】铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4.Mn2+基态的电子排布式可表示为______,NO-3的空间构型为______ (用文字描述);
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.根据等电子原理,CO分子的结构式为______,1molCO2中含有的σ键数目为______;
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图1),a位置上Cl原子的杂化轨道类型为______,已知其中一种化合物的化学式为KCuCl3,另一种的化学式为______;
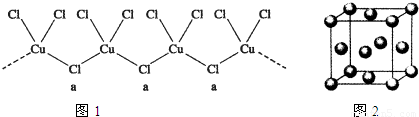
(4)用晶体的x射线衍射法可以测得阿伏加德罗常数.对金属铜的测定得到以下结果:晶胞为面心立方最密堆积(如图2),边长为361pm,又知铜的密度为9.00g/cm3,则铜晶胞的体积是______cm3、晶胞的质量是______g,阿伏加德罗常数为______(列式计算);
(5)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是______.
【答案】分析:(1)Mn是原子序数为25,价电子排布为3d54s2,先失去4s的2个电子,即得Mn2+,NO-3离子中氮原子无孤对电子对,配位原子为3,即N采取sp2杂化;
(2)CO与N2互为等电子体,结构相似,根据氮气分子的结构式书写CO的结构式;二氧化碳分子中含有C═O双键,双键中1个为σ键,1个为π键;
(3)由看图可知:a位置上Cl原子的空间构型是V型,Cl有2个孤电子对,2个σ键,杂化轨道数2+2=4,
由已知条件,不同价态的铜,Cu的化合价是+1、+2,KCuCl3的Cu+2,另一种的化学式中Cu的化合价+1,据此书写;
(4)根据晶胞的边长a,其体积为a3.晶胞的质量=密度×晶胞体积.晶胞中含有4个Cu原子,故铜的摩尔质量= ×晶胞质量×NA,据此计算NA;
×晶胞质量×NA,据此计算NA;
(5)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进反应,过氧化氢具有强氧化性,氨与Cu2+形成配离子.
解答:解:(1)Mn是原子序数为25,价电子排布为3d54s2,先失去4s的2个电子,即得Mn2+,Mn2+基态的电子排布式为1s22s22p63s23p63d5;NO-3离子中氮原子无孤对电子对,配位原子为3,即N采取sp2杂化,NO-3的空间结构为平面三角形,故答案为:1s22s22p63s23p63d5;平面三角形;
(2)CO与N2互为等电子体,结构相似,根据氮气分子的结构式看着CO的结构式为C≡O;
二氧化碳分子中含有C═O双键,双键中1个为σ键,1个为π键,1个二氧化碳分子中含有2个C═O双键,所以1molCO2中含有的σ键数目为2NA,
故答案为:C≡O;2NA;
(3)由看图可知,a位置上Cl原子的空间构型是V型,Cl有2对孤电子对,2个σ键,杂化轨道数为2+2=4,故其杂化方式sp3;由已知条件,不同价态的铜,Cu的化合价是+1、+2,KCuCl3的Cu+2,另一种的化学式中Cu的化合价+1,其化学式是K2CuCl3,故答案为:sp3;K2CuCl3;
(4)根据晶胞的边长a=361pm=3.61×10-8cm,其体积为(3.61×10-8cm)3=4.7×10-23cm3;
晶胞的质量=9.00g/cm3×4.7×10-23cm3=4.23×10-22g;
晶胞中含有4个Cu原子,故63.6g/mol= ×4.23×10-22g×NA,解得NA=6.01×10-23mol-1,
×4.23×10-22g×NA,解得NA=6.01×10-23mol-1,
故答案为:4.7×10-23cm3;4.23×10-22g;6.01×10-23mol-1;
(5)过氧化氢为氧化剂,氨与Cu2+形成配离子,两者能互相促进使反应进行,故答案为:过氧化氢为氧化剂,氨与Cu2+形成配离子,两者能互相促进使反应进行.
点评:本题以科学研究铜锰氧化物作背景,考查学生对电子排布、原子轨道杂化类型与空间构型、等电子体原理、晶胞计算等,难度中等,是对物质结构基础知识和应用能力考查,基础性较强,重点突出.
(2)CO与N2互为等电子体,结构相似,根据氮气分子的结构式书写CO的结构式;二氧化碳分子中含有C═O双键,双键中1个为σ键,1个为π键;
(3)由看图可知:a位置上Cl原子的空间构型是V型,Cl有2个孤电子对,2个σ键,杂化轨道数2+2=4,
由已知条件,不同价态的铜,Cu的化合价是+1、+2,KCuCl3的Cu+2,另一种的化学式中Cu的化合价+1,据此书写;
(4)根据晶胞的边长a,其体积为a3.晶胞的质量=密度×晶胞体积.晶胞中含有4个Cu原子,故铜的摩尔质量=
 ×晶胞质量×NA,据此计算NA;
×晶胞质量×NA,据此计算NA;(5)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进反应,过氧化氢具有强氧化性,氨与Cu2+形成配离子.
解答:解:(1)Mn是原子序数为25,价电子排布为3d54s2,先失去4s的2个电子,即得Mn2+,Mn2+基态的电子排布式为1s22s22p63s23p63d5;NO-3离子中氮原子无孤对电子对,配位原子为3,即N采取sp2杂化,NO-3的空间结构为平面三角形,故答案为:1s22s22p63s23p63d5;平面三角形;
(2)CO与N2互为等电子体,结构相似,根据氮气分子的结构式看着CO的结构式为C≡O;
二氧化碳分子中含有C═O双键,双键中1个为σ键,1个为π键,1个二氧化碳分子中含有2个C═O双键,所以1molCO2中含有的σ键数目为2NA,
故答案为:C≡O;2NA;
(3)由看图可知,a位置上Cl原子的空间构型是V型,Cl有2对孤电子对,2个σ键,杂化轨道数为2+2=4,故其杂化方式sp3;由已知条件,不同价态的铜,Cu的化合价是+1、+2,KCuCl3的Cu+2,另一种的化学式中Cu的化合价+1,其化学式是K2CuCl3,故答案为:sp3;K2CuCl3;
(4)根据晶胞的边长a=361pm=3.61×10-8cm,其体积为(3.61×10-8cm)3=4.7×10-23cm3;
晶胞的质量=9.00g/cm3×4.7×10-23cm3=4.23×10-22g;
晶胞中含有4个Cu原子,故63.6g/mol=
 ×4.23×10-22g×NA,解得NA=6.01×10-23mol-1,
×4.23×10-22g×NA,解得NA=6.01×10-23mol-1,故答案为:4.7×10-23cm3;4.23×10-22g;6.01×10-23mol-1;
(5)过氧化氢为氧化剂,氨与Cu2+形成配离子,两者能互相促进使反应进行,故答案为:过氧化氢为氧化剂,氨与Cu2+形成配离子,两者能互相促进使反应进行.
点评:本题以科学研究铜锰氧化物作背景,考查学生对电子排布、原子轨道杂化类型与空间构型、等电子体原理、晶胞计算等,难度中等,是对物质结构基础知识和应用能力考查,基础性较强,重点突出.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目