题目内容
现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途.
(1)已知:2C(s)+O2(g)=2CO(g);△H1,2H2(g)+O2(g)=2H2O(g);△H2.
则反应C(s)+H2O(g)?CO(g)+H2(g);△H=
(△H1-△H2)
(△H1-△H2).(用含△H1、△H2的代数式表示)
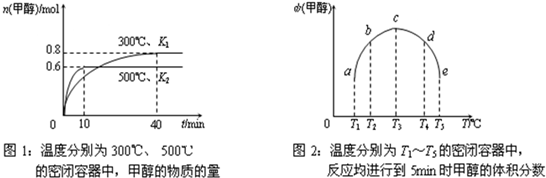
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2.
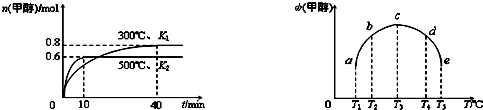
图1:温度分别为300℃、500℃的密 图2:温度分别为T1~T5的密闭容器中反应
闭容器中,甲醇的物质的量 均进行到5min时甲醇的体积分数
①该反应的△H3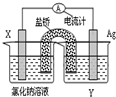
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有
(3)依据反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s) 设计的原电池如图所示:电极X的材料是
(1)已知:2C(s)+O2(g)=2CO(g);△H1,2H2(g)+O2(g)=2H2O(g);△H2.
则反应C(s)+H2O(g)?CO(g)+H2(g);△H=
| 1 |
| 2 |
| 1 |
| 2 |
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H3.现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2.

图1:温度分别为300℃、500℃的密 图2:温度分别为T1~T5的密闭容器中反应
闭容器中,甲醇的物质的量 均进行到5min时甲醇的体积分数
①该反应的△H3
<
<
0(选填“<”、“>”或“=”,下同),K1>
>
K2.
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有
升高温度或降低压强
升高温度或降低压强
.(3)依据反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s) 设计的原电池如图所示:电极X的材料是
Fe
Fe
;电解质溶液Y是硫酸铜溶液或氯化铜溶液等
硫酸铜溶液或氯化铜溶液等
;若Y为氯化钠溶液,则经过一段时间,发现X极上出现锈斑,则此过程中正极的电极反应式为O2+2H2O+4e?═4OH-
O2+2H2O+4e?═4OH-
.分析:(1)观察已知热化学方程式,根据盖斯定律,前者减后得2C(s)+2H2O(g)?2CO(g)+2H2(g),据此计算;
(2)①由图1可知,温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应移动,故平衡常数减小,据此解答;
②由图2可知,最高点开始向后处于平衡状态,由c状态到d状态,甲醇的含量降低,采取措施平衡向逆反应移动,结合反应特征及外界条件度平衡移动影响解答;
(3)由反应可知,铁发生氧化反应,活泼性强于Ag,作负极,Ag电极反应还原反应,铜离子在Ag电极放电,故Y溶液为铜盐溶液;
若Y为氯化钠溶液,则发生铁的原电池腐蚀,为吸氧腐蚀,氧气在正极放电生成氢氧根离子.
(2)①由图1可知,温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应移动,故平衡常数减小,据此解答;
②由图2可知,最高点开始向后处于平衡状态,由c状态到d状态,甲醇的含量降低,采取措施平衡向逆反应移动,结合反应特征及外界条件度平衡移动影响解答;
(3)由反应可知,铁发生氧化反应,活泼性强于Ag,作负极,Ag电极反应还原反应,铜离子在Ag电极放电,故Y溶液为铜盐溶液;
若Y为氯化钠溶液,则发生铁的原电池腐蚀,为吸氧腐蚀,氧气在正极放电生成氢氧根离子.
解答:解:(1)已知:①2C(s)+O2(g)=2CO(g);△H1,
②2H2(g)+O2(g)=2H2O(g);△H2.
由盖斯定律,①-②得2C(s)+2H2O(g)?2CO(g)+2H2(g),故2△H=△H1-△H2,所以△H=
(△H1-△H2),
故答案为:
(△H1-△H2);
(2)①由图1可知,温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H3<0,升高温度平衡向逆反应移动,平衡常数减小,故K1>K2,
故答案为:<;>;
②由图2可知,最高点开始向后处于平衡状态,由c状态到d状态,甲醇的含量降低,该反应正反应是体积减小的放热反应,故可以升高温度或降低压强,使平衡向逆反应移动,
故答案为:升高温度或降低压强;
(3)由反应可知,铁发生氧化反应,活泼性强于Ag,作负极,故电极X的材料为Fe,Ag电极反应还原反应,铜离子在Ag电极放电,故Y溶液为铜盐溶液,如硫酸铜溶液或氯化铜溶液等,
若Y为氯化钠溶液,则发生铁的原电池腐蚀,为吸氧腐蚀,氧气在正极放电生成氢氧根离子,电极反应式为O2+2H2O+4e?═4OH-,.
故答案为:Fe;硫酸铜溶液或氯化铜溶液等;O2+2H2O+4e?═4OH-.
②2H2(g)+O2(g)=2H2O(g);△H2.
由盖斯定律,①-②得2C(s)+2H2O(g)?2CO(g)+2H2(g),故2△H=△H1-△H2,所以△H=
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
(2)①由图1可知,温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H3<0,升高温度平衡向逆反应移动,平衡常数减小,故K1>K2,
故答案为:<;>;
②由图2可知,最高点开始向后处于平衡状态,由c状态到d状态,甲醇的含量降低,该反应正反应是体积减小的放热反应,故可以升高温度或降低压强,使平衡向逆反应移动,
故答案为:升高温度或降低压强;
(3)由反应可知,铁发生氧化反应,活泼性强于Ag,作负极,故电极X的材料为Fe,Ag电极反应还原反应,铜离子在Ag电极放电,故Y溶液为铜盐溶液,如硫酸铜溶液或氯化铜溶液等,
若Y为氯化钠溶液,则发生铁的原电池腐蚀,为吸氧腐蚀,氧气在正极放电生成氢氧根离子,电极反应式为O2+2H2O+4e?═4OH-,.
故答案为:Fe;硫酸铜溶液或氯化铜溶液等;O2+2H2O+4e?═4OH-.
点评:本题考查反应热的计算、影响化学平衡元素、平衡图象、原电池等,题目综合性较大,难度中等,(3)中注意根据氧化还原反应设计原电池.

练习册系列答案
相关题目

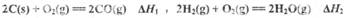
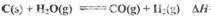 =_______,(用含
=_______,(用含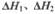 的代数式表示)
的代数式表示) ΔH3 。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
ΔH3 。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。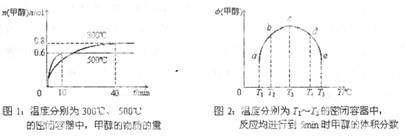
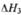 _______O (选填“<”、“>”或“=”)。
_______O (选填“<”、“>”或“=”)。