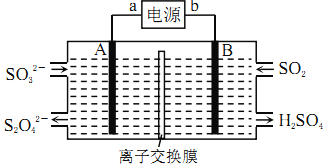
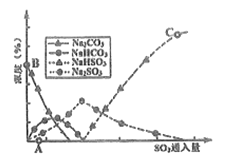
题目内容
【题目】(5分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
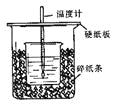
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),
【答案】1)环形玻璃搅拌器(2)减少实验过程中热量损失(3)偏小(4)不相等;相等;因为中和热是指在稀溶液中,酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱用量无关
【解析】
(1)根据所以装置图结合实验原理判断仪器;
(2)根据中和热测定实验过程中要尽可能减少热量损失分析;
(3)根据中和热测定实验过程中要尽可能减少热量损失分析;
(4)根据反应物的用量判断放出的热量,根据中和热概念分析。
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒。
(2)实验过程中尽可能减少热量的损失,因此烧杯间填满碎纸条的作用是保温,减少实验过程中的热量损失。
(3)大烧杯上如不盖硬纸板,导致热量散失,求得的中和热数值偏小。
(4)如果实验中改用60 mL0.50 mol·L-1的盐酸跟50mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,生成水的物质的量增加,所放出的热量不相等;中和热是强酸、强碱生成1mol水所对应的反应热,因此所求中和热相等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
浓度c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
溶液 | 氨水 | CH3COONa溶液 | 醋酸 | 盐酸 |
A.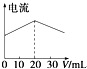 在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO﹣)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
D.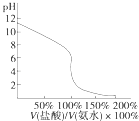 用④滴定①,滴定曲线如图,可用酚酞作指示剂
用④滴定①,滴定曲线如图,可用酚酞作指示剂