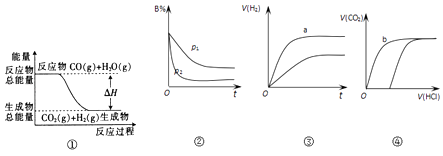
��Ŀ����
����Ŀ���ݱ����������⻯����NaBH4��BԪ�صĻ��ϼ�Ϊ+3����H2O2��ԭ�ϵ�ȼ�ϵ�ؿ������վ�ͨ�����ǵ�Դ���������ϲ���Pt/C���������ϲ���MnO2 �� �乤��ԭ����ͼ��ʾ������˵����ȷ���ǣ������� 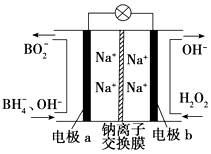
A.ÿ����1 mol H2O2 �� ת�Ƶĵ���Ϊ1 mol
B.�缫b����MnO2 �� MnO2�����缫�������д�����
C.�õ�ص�������ӦΪBH4��+8OH����8e���TBO2��+6H2O
D.��طŵ�ʱNa+��b��������a����
���𰸡�B
���������⣺A������H2O2�õ��ӱ���ԭ����OH�����缫��ӦʽΪH2O2+2e��=2OH��������ÿ����1molH2O2��ת�Ƶĵ���Ϊ2mol����A����
B���缫b����MnO2��MnO2���缫���ϣ�Ϊ���������������ã���B��ȷ��
C��BH4��������ΪBO2����ӦΪԭ��صĸ�����Ӧ���缫��ӦʽΪBH4��+8OH����8e��=BO2��+6H2O����C����
D��BH4��������ΪBO2����ӦΪԭ��صĸ�����Ӧ������H2O2�õ��ӱ���ԭ����OH����ԭ��ع���ʱ���������������ƶ������طŵ�ʱNa+��a��������b��������D����
��ѡB��
��ԭ��ع���ԭ��ʾ��ͼ��֪��Ӧ��BH4��������ΪBO2����ӦΪԭ��صĸ�����Ӧ���缫��ӦʽΪBH4��+8OH����8e��=BO2��+6H2O������H2O2�õ��ӱ���ԭ����OH�����缫��ӦʽΪH2O2+2e��=2OH����ԭ��ع���ʱ���������������ƶ������������ƶ����Դ˽����⣮