题目内容
某温度下,在一容积不变的密闭容器中,反应A(g) + 2B (g)  3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
A.向左移动 B.向右移动 C.不移动 D.无法判断
A
解析试题分析:由于平衡时反应物的总物质的量为3+2=5mol,生成物为4mol,若同时加入A和C各一摩尔,生成物的变化比较大,相对于反应物来说浓度增加比较快。根据勒夏特列原理,反应会向减弱这种趋势反应,所以向逆反应进行,即是向左进行。因此选项为A。
考点:考查浓度对化学平衡移动的影响的知识。

 阅读快车系列答案
阅读快车系列答案一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g)  Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
| A.反应进行60s时,X、Y、Z的浓度相等 |
| B.反应进行80s时,逆反应速率大于正反应速率 |
| C.以X浓度变化表示的反应速率为0.06mol/(L?min) |
| D.反应进行80s时,Y物质的量浓度为0.03mol/L |
加热N2O5时,发生以下两个反应:N2O5 N2O3 + O2,N2O3
N2O3 + O2,N2O3 N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( )
N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( )
| A.1.44mol?L-1 | B.3.48mol?L-1 | C.0.94mol?L-1 | D.1.98mol?L-1 |
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是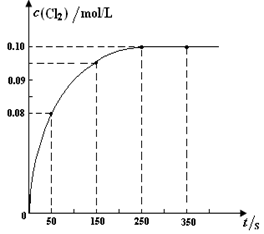
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025 |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |
在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)  2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 ( )
2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的量相等,则这时A的转化率为 ( )
| A.40% | B.50% | C.60% | D.70% |
高温下,某反应达平衡,化学平衡常数表达式为: ,恒容时,温度升高H2浓度减小。下列说法正确的是
,恒容时,温度升高H2浓度减小。下列说法正确的是
A.该反应化学方程式为:CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
| B.恒温恒容下,反应达平衡时,再通入一定量的CO2,CO的体积分数一定增大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
2Z(g)一定达到化学平衡状态的是①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |
下列说法正确的是
| A.反应2Mg+CO22MgO+C ΔH<0从熵变角度看,可以自发进行 |
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
 2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是