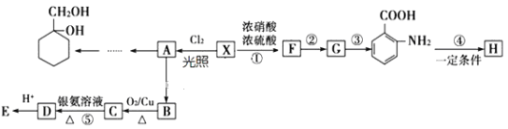
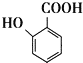
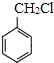
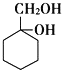
题目内容
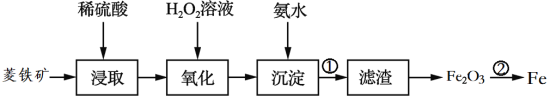
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验

(苯,一种不溶于水,密度比水小的液体):
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(______)(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____;步骤⑤的实验操作名称是_____。
(3)步骤⑤中应充分振荡,然后静置,待分层后(______)(填标号)
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4) ④过程的离子方程式_____。
【答案】BDE 过滤 萃取、分液 D 2I- +H2O2+ 2H+ = I2+ 2H2O
【解析】
由实验流程可知,海带在坩埚中灼烧后溶解,然后过滤得到含碘离子的溶液,④中发生氧化还原反应生成碘单质,⑤发生萃取得到含碘的有机溶液,⑥蒸馏得到碘单质。
(1)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,故答案为:BDE;
(2)海带在坩埚中灼烧后溶解,然后过滤得到含碘离子的溶液,所以步骤③的实验操作名称是过滤;发生萃取得到含碘的有机溶液,⑤的实验操作名称是萃取、分液,故答案为:过滤;萃取、分液;
(3)步骤⑤是萃取、分液,苯来提取碘的理由是碘在苯中的溶解度大于在水中的溶解度,且苯和水不互溶、和碘水不反应;在分液操作中,应充分振荡,然后静置,待分层后先将水层(密度大于苯,在下层)从分液漏斗的下口放出,再将含碘苯溶液从上口倒出,选D;故答案为:D。
(4)④中发生氧化还原反应生成碘单质,在酸性条件下,过氧化氢氧化碘负离子的离子反应方程式为:2I- +H2O2+ 2H+ = I2+ 2H2O,故答案为:2I- +H2O2+ 2H+ = I2+ 2H2O。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案