题目内容
【题目】完成下列各题:
(1)写出电子式NH4Cl _______ ,它的阳离子价层电子对对数为______,该离子空间构型为_______。
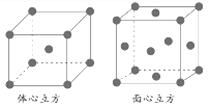
(2)周期表一共18列,第四周期第11列元素A,表示A所在族的符号为_________,它的基态原子结构示意图为_____,A+离子的价层电子排布图为____________,A2+离子的价层电子排布式为_____________,A+离子和A2+离子较稳定的是(填离子符号)_______,原因________________________。
(3)乙炔和乙烯分子,它们的σ键个数之比为______,乙烯分子中C原子杂化方式为________,C、N、O三种原子第一电离能从大到小排列____________。
【答案】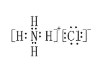 4 正四面体 ⅠB
4 正四面体 ⅠB 
![]() 3d9 Cu+ 因为Cu+的价层电子排布式为3d10,是全充满的稳定状态,故Cu+比Cu2+稳定 3:5 sp2杂化 N>O>C
3d9 Cu+ 因为Cu+的价层电子排布式为3d10,是全充满的稳定状态,故Cu+比Cu2+稳定 3:5 sp2杂化 N>O>C
【解析】
(1)铵根中氮原子与每个氢原子共用一对电子,故电子式为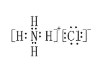 ;N的价层电子对数为4+
;N的价层电子对数为4+![]() ×(5-1-4×1)=4,由于没有孤电子对,所以空间构型为正四面体,故答案为:
×(5-1-4×1)=4,由于没有孤电子对,所以空间构型为正四面体,故答案为: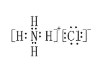 ;4;正四面体;
;4;正四面体;
(2)第四周期第11列为第ⅠB族,为第29号元素,即Cu元素,核电荷数为29,核外有29个电子,它的基态原子结构示意图为 ,核外电子排布为:1s22s22p63s23p63d104s1;Cu+为铜原子失去最外层一个电子形成,所以价层电子排布图为
,核外电子排布为:1s22s22p63s23p63d104s1;Cu+为铜原子失去最外层一个电子形成,所以价层电子排布图为![]() ;Cu2+为铜原子失去4s一个电子和3d一个电子形成,所以价层电子排布为3d9;轨道全满或半满状态比较稳定所以亚铜离子比铜离子稳定,故答案为:ⅠB;
;Cu2+为铜原子失去4s一个电子和3d一个电子形成,所以价层电子排布为3d9;轨道全满或半满状态比较稳定所以亚铜离子比铜离子稳定,故答案为:ⅠB; ;
; ![]() ;3d9; Cu+;因为Cu+的价层电子排布式为3d10,是全充满的稳定状态,故Cu+比Cu2+稳定;
;3d9; Cu+;因为Cu+的价层电子排布式为3d10,是全充满的稳定状态,故Cu+比Cu2+稳定;
(3)乙炔分子含有3个σ键,乙烯分子含有5个σ键,它们的σ键个数之比为3:5,乙烯分子中一个C的价层电子对数为![]() ,所以杂化类型为sp2杂化;C、N、O属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大呈增大趋势,但第ⅤA族的大于相邻的第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:3:5;sp2杂化;N>O>C;
,所以杂化类型为sp2杂化;C、N、O属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大呈增大趋势,但第ⅤA族的大于相邻的第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:3:5;sp2杂化;N>O>C;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案