题目内容
3.A、B、C、D均为短周期元素,A和C处于同主族,两者间隔一周期,A元素和B元素的原子两者核电荷数之差为5,B原子核外M电子层比L电子层少两个电子,D的单质在常温常压下为黄绿色有毒的气体.则(1)A的原子结构示意图为
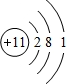 ;
;(2)B在周期表中的位置为第三周期第VIA族;
(3)C可与多种元素的原子形成10电子分子,其常温下呈液态的是H2O;
(4)D的单质与NaOH溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO.
分析 A、B、C、D均为短周期元素,B原子核外M电子层比L电子层少两个电子,则B原子M层电子数是6,为S元素;D的单质在常温常压下为黄绿色有毒的气体,则D为Cl元素;
A元素和B元素的原子两者核电荷数之差为5,则A为Na元素,A、C同一主族且两者间隔一周期,则CH元素,再结合原子结构、物质性质分析解答.
解答 解:A、B、C、D均为短周期元素,B原子核外M电子层比L电子层少两个电子,则B原子M层电子数是6,为S元素;D的单质在常温常压下为黄绿色有毒的气体,则D为Cl元素;
A元素和B元素的原子两者核电荷数之差为5,则A为Na元素,A、C同一主族且两者间隔一周期,则C是H元素,
(1)A是Na元素,Na原子结构示意图为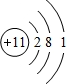 ,
,
故答案为: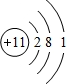 ;
;
(2)B是S元素,其原子核外有3个电子层、最外层电子数是6,在周期表中的位置为第三周期第VIA族,故答案为:第三周期第VIA族;
(3)C是H元素,H元素可与多种元素的原子形成10电子分子,其常温下呈液态的是H2O,故答案为:H2O;
(4)D是Cl元素,氯气与NaOH溶液反应生成氯化钠、次氯酸钠和水,所以该反应的化学方程式为Cl2+2NaOH=NaCl+NaClO,
故答案为:Cl2+2NaOH=NaCl+NaClO.
点评 本题考查位置结构性质相互关系及应用,为高频考点,侧重考查元素周期表、原子结构及物质性质,熟悉常见10电子微粒及18电子微粒,题目难度不大.

练习册系列答案
相关题目
11.下列离子组合,能够大量共存的是( )
| A. | 酸性溶液中:Al3+、Fe3+、SO42-、SCN- | |
| B. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| C. | FeCl3溶液中:Na+、K+、SO42-、I- | |
| D. | 强酸性溶液中:Na+、Fe2+、SO42-、NO3- |
14.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | 光气(COCl2) | B. | 六氟化硫 | C. | 三氯化硼 | D. | 五氯化磷 |
11.下列有机物分子中,所有原子一定不在同一平面内的是( )
| A. |  | B. | 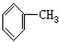 | C. | 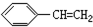 | D. | 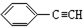 |
18.下列各组有机物,不管它们以何种比例混合,只要总质量一定,则完全燃烧时消耗氧气为一定值的是( )
| A. | C4H6、C3H8 | B. | C2H2、C6H6 | C. | C2H6O、C2H4 | D. | C3H6、C3H8 |
8.以下能级符号错误的是( )
| A. | 6s | B. | 2d | C. | 3 p | D. | 7 f |
15.关于晶体的下列叙述正确的是( )
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 离子晶体中可能含有共价键 | |
| C. | 原子晶体中的相邻原子间只存在非极性共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |
12.只需一种试剂即可将苯酚溶液、四氯化碳、己烯、甲苯四种无色液体区分开来,该试剂是( )
| A. | 新制Cu(OH)2悬浊液 | B. | KMnO4溶液 | C. | 溴水 | D. | FeCl3溶液 |
13.如图是某种浓硫酸试剂瓶标签上的部分数据,则该浓硫酸的物质的量浓度是( )


| A. | 4.9mol/L | B. | 9.8mol/L | C. | 18.4mol/L | D. | 36.8mol/L |