题目内容
11.下列离子组合,能够大量共存的是( )| A. | 酸性溶液中:Al3+、Fe3+、SO42-、SCN- | |
| B. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| C. | FeCl3溶液中:Na+、K+、SO42-、I- | |
| D. | 强酸性溶液中:Na+、Fe2+、SO42-、NO3- |
分析 A.铁离子与硫氰根离子结合生成络合物硫氰化铁;
B.四种离子之间不发生反应,为透明溶液;
C.铁离子与碘离子之间发生氧化还原反应;
D.硝酸根离子在酸性溶液中具有强氧化性,能够氧化亚铁离子.
解答 解:A.Fe3+、SCN-之间发生反应生成硫氰化铁,在溶液中不能大量共存,故A错误;
B.MnO4-、K+、Na+、NO3-之间不反应,为透明溶液,故B正确;
C.氯化铁电离出的铁离子具有氧化性,Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.在强酸性溶液中发生氧化还原反应,Fe2+、NO3-在溶液中不能大量共存,故D错误;
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.据湖北电视台2000年3月6日报道,汉江流域发生第三次“水华”现象,江面上有大量的白色漂浮物,类似于海面上“红潮”,取水样分析:绿藻含量比正常情况下偏高很多,含O2量明显偏低,浑浊度增加.造成汉江“水华”现象最可能的原因是( )
| A. | 水土流失 | |
| B. | 汉江流域农业生产中长期使用农药 | |
| C. | 生活废水大量排入汉江,使水质富营养化 | |
| D. | 有毒的废水大量排入汉江 |
2.短周期元素X、Y、Z、W的原子序数依次增大.X的原子半径比Y的小,且X与Y的最外层电子数之和等于Z的最外层电子数.X与W同主族,Z是地壳中含量最高的元素.下列说法不正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X) | |
| B. | 元素Z、W的简单离子的电子层结构相同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | X、Y两种元素可形成分别含有10e-和18e-的化合物 |

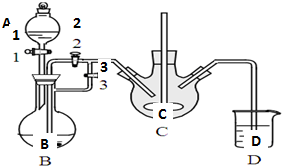 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得: ;
;