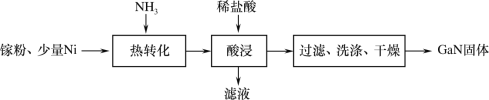
题目内容
【题目】用0.1000mol·L-1NaOH溶液分别滴定20.00ml0.1000mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COOH)>c(CH3COO-)
C.pH=7时,滴定盐酸消耗V(NaOH)大于醋酸消耗V(NaOH)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)═c(Cl-)
【答案】C
【解析】
A.滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故A错误;
B. 加入10mL氢氧化钠时,醋酸与氢氧化钠溶液反应得到同浓度的醋酸和醋酸钠混合液,由图可知,溶液呈酸性,说明醋酸电离程度大于醋酸根离子的水解程度,则溶液中c(CH3COO-)>c(CH3COOH),故B错误;
C. 醋酸钠水解呈碱性,氯化钠不水解,pH=7时,盐酸完全反应,醋酸与氢氧化钠溶液反应得到醋酸和醋酸钠的混合液,则醋酸所用NaOH溶液的体积小,故C正确;
D. V(NaOH)=20.00mL时,盐酸和醋酸与氢氧化钠溶液反应生成氯化钠和醋酸钠,由于醋酸根离子发生水解,则c(CH3COO-)<c(Cl-),故D错误;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】对于反应:2SO2+O2![]() 2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。
2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。
编号 | 改变的条件 | 生成的SO3的速率 |
① | 降低温度 | _______ |
② | 升高温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 恒容下充入Ne | _______ |
⑤ | 压缩体积 | _______ |
⑥ | 使用催化剂 | _______ |
【题目】实验室中有一未知浓度的醋酸,某学生用0.1000 mol·L-1 NaOH标准溶液进行测定醋酸的浓度的实验,取20.00mL待测醋酸放入锥形瓶中,并滴加2~3滴指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:
实验编号 | 待测醋酸的体积/mL | NaOH溶液的浓度/mol·L-1 | 消耗NaOH溶液的体积/mL |
1 | 20.00 | 0.1000 | 25.18 |
2 | 20.00 | 0.1000 | 23.06 |
3 | 20.00 | 0.1000 | 22.98 |
(1)该实验中指示剂最好选用___________,滴定达到终点的标志是_____________________。
(2)排除碱式滴定管尖嘴中气泡的方法应采用以下_________操作(填甲/乙/丙),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)根据上述数据,可计算出该醋酸的浓度为_________mol·L-1(保留小数点后4位)。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________。
A.用滴定管取20.00mL待测醋酸,使用前,水洗后未用待测醋酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消关