题目内容
(6分)常温下,取0.2 mol/L HA溶液与0.2 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(2)已知NH4A溶液显中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(3)有相同温度下相同浓度的四种盐溶液:
(1)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(2)已知NH4A溶液显中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(3)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl。按pH由大到小的顺序排列__________________(填字母序号)。 |
(1)> (2)> (3) ABDC
混合后相当于0.1mol/L NaA,A― 水解促进水电离,⑴(1)> (2)酸性HA大于H2CO3 ,NH4HCO3水解后呈碱性,PH >7(3) ABDC

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
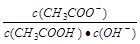 不变
不变