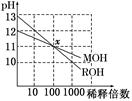
题目内容
下列说法正确的是
| A.25℃时,NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
B.25℃时,向10mL pH=3的醋酸溶液中加入水稀释后,溶液中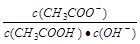 不变 不变 |
| C.25℃时,pH=12的氨水和pH=2的盐酸溶液等体积混合,c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
B
A:KW随温度的升高面增大
B:由题意得:
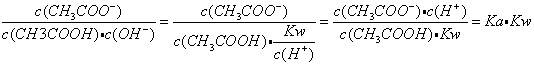 ,而Ka与Kw只随温度改变,故溶液中
,而Ka与Kw只随温度改变,故溶液中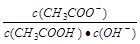 的值不变
的值不变
C: pH=12的氨水和pH=2的盐酸溶液等体积混合,氨水过量,最终溶液呈碱性。
D:注意温度,在100℃时,Kw大于10—14,故NaOH溶液中的OH—浓度大于10—2mol/L,相对盐酸为讲过量,即混合后溶液呈碱性。
故答案为B
B:由题意得:
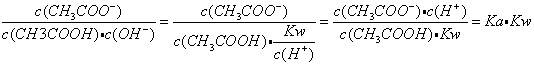 ,而Ka与Kw只随温度改变,故溶液中
,而Ka与Kw只随温度改变,故溶液中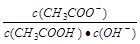 的值不变
的值不变C: pH=12的氨水和pH=2的盐酸溶液等体积混合,氨水过量,最终溶液呈碱性。
D:注意温度,在100℃时,Kw大于10—14,故NaOH溶液中的OH—浓度大于10—2mol/L,相对盐酸为讲过量,即混合后溶液呈碱性。
故答案为B

练习册系列答案
相关题目

 OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )