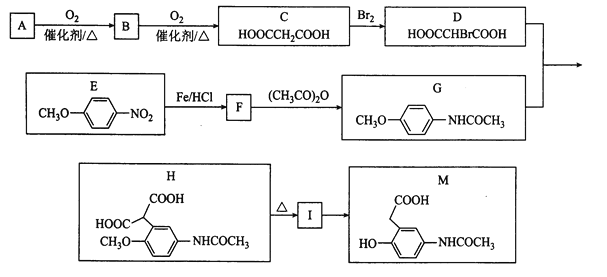
题目内容
【题目】3.2 g某元素A 的单质与氢气化合生成3.4 g气态氢化物H2A,已知A 的原子核中质子数和中子数相等,则:
(1) A的原子序数为______;
(2) 元素A位于元素周期表中位置:____ _____;
(3) 气态氢化物的化学式是_____,并书写气态氢化物的电子式_______。
【答案】16 第三周期 第ⅥA族 H2S ![]()
【解析】
(1)根据质量守恒定律,3.2g某元素A的单质与氢气化合生成3.4g气态氢化物H2A,求出参加反应的氢气的质量,根据n(H2)= n(H2A)=n(A),求出n(A),根据M(A)=m/n求出A的摩尔质量,摩尔质量与相对分子质量数值相等,A的原子核中质子数和中子数相等,进而求出A的原子序数,确定该元素;
(2)对于主族元素,周期数=电子层数,族序数=最外层电子数,据此判断该元素在周期表中位置;
(3)H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键。
(1)根据质量守恒定律,3.2g某元素A的单质与氢气化合生成3.4g气态氢化物H2A,参加反应的氢气的质量为3.4g-3.2g=0.2g,n(H2)=![]() =0.1mol,则n(H2)=n(A)=0.1mol,M(A)=
=0.1mol,则n(H2)=n(A)=0.1mol,M(A)=![]() =32g/mol,摩尔质量与相对分子质量数值相等,故A的相对分子质量为32,则质量数为32,已知A的原子核中质子数和中子数相等,所以A的原子序数为
=32g/mol,摩尔质量与相对分子质量数值相等,故A的相对分子质量为32,则质量数为32,已知A的原子核中质子数和中子数相等,所以A的原子序数为![]() =16,故A为硫元素;
=16,故A为硫元素;
答案是:16;
(2)A为硫元素,由A原子结构可知,A电子层数为3,最外层电子数为6,故元素A位于元素周期表中第三周期第ⅥA族;
答案是:第三周期第ⅥA族;
(3)S的氢化物为H2S,是共价化合物,硫原子中最外层达8个电子稳定结构,分子中存在两个H-S键,电子式为:![]() ;
;
答案是:H2S;![]() 。
。