题目内容
【题目】一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。

下列说法正确的是
A. 接通电路后,电池的正极质量减小
B. 若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
C. M电极材料为铜片
D. 接通电路后,AgNO3溶液的浓度减小
【答案】A
【解析】由电池总反应可知,正极极反应:Cu2Cl2+2e-=2Cu+2Cl-,接通电路后正极质量减小,A正确;若反应消耗1molMg,转移2mol电子,就会有2molCl-通过阴离子交换膜,B错误;M电极为阳极,电极材料应为镀层金属,故M电极材料为银片,C错误;电镀过程,电解质溶液的组成和浓度保持不变,D错误;正确选项A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有________。
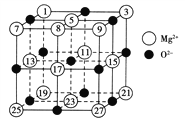
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如图所示,请改正图中错误:__________________。
(3)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1 266 | 1 534 | 183 |
解释表中氟化物熔点差异的原因:_____________________________________。