题目内容
【题目】2017年,中科院大连化学物理研究所碳资源小分子与氢能利用创新特区研究组(DNL19T3)孙剑、葛庆杰研究员团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1) 工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_____________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是_________________。
(2) 该研究成果用CO2制取高辛烷值汽油的路线是先将CO2按逆水煤气反应生成CO,然后由CO与H2反应生成烃,产物中汽油组分占所有烃类产物的百分比近80%。
① 已知:H2 (g)+![]() O2 (g) === H2O(l) ΔH1= —285.8 kJ·mol-1
O2 (g) === H2O(l) ΔH1= —285.8 kJ·mol-1
C8H18(l)+![]() O2(g) === 8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1
O2(g) === 8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方
程式__________________________。
② 在一实验容器中充入一定量的CO2和H2,若加入催化剂恰好完全反应,且产物只生成C5以上的烃类物质和水,则CO2与H2的物质的量之比不低于________。
(3) 二甲醚(CH3OCH3)的十六烷值高,燃烧尾气中污染物少,可代替柴油。CO、CO2混合加氢的方法是在一个反应器中将合成气直接转化为二甲醚,包括以下4个反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ①
CH3OH(g)+H2O(g) ①
CO2(g)+H2(g)![]() CO(g)+H2O(g) ②
CO(g)+H2O(g) ②
CO(g)+2H2(g)![]() CH3OH(g) ③
CH3OH(g) ③
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ④
CH3OCH3(g)+H2O(g) ④
① 已知反应④在某温度下的平衡常数为K=400。此温度下,在一恒容密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
此时正、逆反应速率的大小:v(正) ______ v(逆) (填“>”、“<”或“=”)。
若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=_____。
② 某科研小组在反应温度503K~543K,反应压强分别是3、4、5、6、7MPa,n(CO)/n(CO+CO2)=0.5的情况下计算了二甲醚的平衡收率(二甲醚实际产量与反应物总量之比),结果如图1所示。


a~e曲线分别对应不同的压强条件,则e对应的压强是______,理由是___________。
该科研小组在反应温度523K、反应压强5MPa的条件下,按照合成反应的化学计量比进料,改变n(CO)/n(CO+CO2)的比例,二甲醚的平衡收率的变化规律如图2所示。
由图2可知,二甲醚的平衡收率随着n(CO)/n(O+CO2)比值的增大而单调上升,其原因是________________________________________________。
【答案】 NH3+CO2+H2O=== NH4HCO3 (或NH3·H2O +CO2 === NH4HCO3) 降低吸收过程中氨水的挥发,促进氨水对CO2的吸收 8CO2(g)+25 H2(g) === C8H18(l) +16H2O(l) ΔH= —1627kJ·mol-1 ![]() > 0.16 mol·L-1·min-1 7MPa 合成二甲醚的总反应为气体分子数减少的反应,压强越大,二甲醚的平衡产率越大 增大CO浓度,消耗了反应体系中的水,促进反应④平衡正向移动,增加了产品的平衡收率
> 0.16 mol·L-1·min-1 7MPa 合成二甲醚的总反应为气体分子数减少的反应,压强越大,二甲醚的平衡产率越大 增大CO浓度,消耗了反应体系中的水,促进反应④平衡正向移动,增加了产品的平衡收率
【解析】(1) 用氨水吸收过量的CO2生成NH4HCO3,发生反应的化学方程式为NH3+CO2+H2O=NH4HCO3;氨水不稳定,为降低吸收过程中氨水的挥发,促进氨水对CO2的吸收,烟气需冷却至15.5~26.5℃再用氨水吸收;
(2) ① 已知:I、H2 (g)+![]() O2 (g) = H2O(l) ΔH1= —285.8 kJ·mol-1,Ⅱ、C8H18(l) +
O2 (g) = H2O(l) ΔH1= —285.8 kJ·mol-1,Ⅱ、C8H18(l) +![]() O2(g) =8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1,根据盖斯定律,由I×25-Ⅱ可得8CO2(g)+25H2(g) = C8H18(l) +16H2O(l),此时ΔH=ΔH1×25-ΔH2=(—285.8 kJ·mol-1)×25-(—5518 kJ·mol-1)=—1627kJ·mol-1,即CO2与H2反应生成汽油(以C8H18表示)的热化学方程式为8CO2(g)+25 H2(g) = C8H18(l) +16H2O(l) ΔH = —1627kJ·mol-1;
O2(g) =8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1,根据盖斯定律,由I×25-Ⅱ可得8CO2(g)+25H2(g) = C8H18(l) +16H2O(l),此时ΔH=ΔH1×25-ΔH2=(—285.8 kJ·mol-1)×25-(—5518 kJ·mol-1)=—1627kJ·mol-1,即CO2与H2反应生成汽油(以C8H18表示)的热化学方程式为8CO2(g)+25 H2(g) = C8H18(l) +16H2O(l) ΔH = —1627kJ·mol-1;
②根据原子守恒,生成C5以上的烃类物质和水,设CO2的物质的量为5mol时,则生成1molC5H12和10mol水,消耗H2的物质的量为16mol,故CO2与H2的物质的量之比不低于5:16;
(3)① Qc=![]() =
=![]() =1.86<400,则此时反应正向进行,即v(正)>v(逆);
=1.86<400,则此时反应正向进行,即v(正)>v(逆);
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始浓度(mol/L) 0.44 0.6 0.6
变化浓度(mol/L) 2c c c
平衡浓度(mol/L) 0.44-2c 0.6+c 0.6+c
K=![]() =
=![]() =400,解得:c=0.08mol/L,该时间内反应速率v(CH3OH)=
=400,解得:c=0.08mol/L,该时间内反应速率v(CH3OH)=![]() =0.016 mol·L-1·min-1。
=0.016 mol·L-1·min-1。
②因合成二甲醚的总反应为气体分子数减少的反应,压强越大,二甲醚的平衡产率越大,故a~e曲线中e对应的压强最大,即e对应的压强是7MPa;
因增大CO浓度,消耗了反应体系中的水,促进反应④平衡正向移动,增加了产品的平衡收率,故二甲醚的平衡收率随着n(CO)/n(CO+CO2)比值的增大而单调上升。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】工业上主要采用软锰矿和闪锌矿联合生产MnO2和锌。软锰矿主要成分为MnO2;还含少量Al2O3和SiO2杂质。闪锌矿主要成分为ZnS,还含少量FeS、CuS杂质。现用稍过量的软锰矿和闪锌矿为原料,经过一系列处理后分别在两个电极生成产品“MnO2和锌”。工艺流程如下:
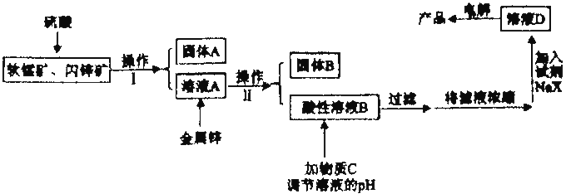
已知:Ⅰ:金属硫化物、硫酸、二氧化锰三者发生的反应均是氧化还原反应。
例如:MnO2+ZnS+2H2SO4![]() MnSO4+ZnSO4+S+2H2O.
MnSO4+ZnSO4+S+2H2O.
Ⅱ:4X-+Mn2+![]() MnX42-,X-不参与电极反应。Zn2+与X-不反应。
MnX42-,X-不参与电极反应。Zn2+与X-不反应。
Ⅲ:各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | A13+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)操作I的名称是_____________________。
(2)物质C是MnO2和ZnO的混合物。加入物质C充分作用后,过滤,所得固体的成分是________(用化学式表示)。
(3)电解溶液D的装置如下图所示,两个电极都是惰性电极。

①硫酸钠的作用是________________________。
②b电极的电极反应式是______________________。a电极的电极反应式是_______________________。
(4)若一定质量的闪锌矿中含1.76kgFeS,则在上述流程中1.76kgFeS消耗MnO2的质量为_______kg。
(5)现有0.4mol/L Mn(NO3)2、 0.8mol/LZn(NO3)2的混合溶液100mL,向该混合液中逐滴加入Na2S溶液,当MnS沉淀一定程度时,测得c(Mn2+)=2.0×10-3 mol/L,则此时c(Zn2+)=________[已知Ksp(ZnS)=1.3×10-24,Ksp(MnS)=2.6×10-13]



