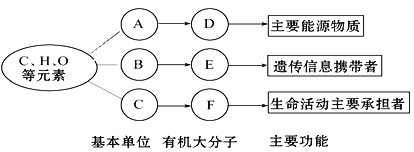
题目内容
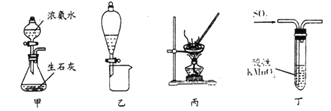
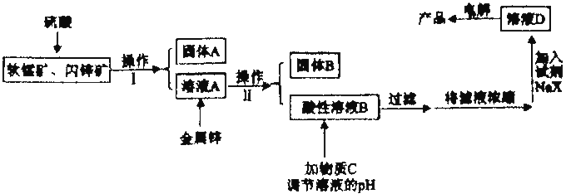
【题目】工业上主要采用软锰矿和闪锌矿联合生产MnO2和锌。软锰矿主要成分为MnO2;还含少量Al2O3和SiO2杂质。闪锌矿主要成分为ZnS,还含少量FeS、CuS杂质。现用稍过量的软锰矿和闪锌矿为原料,经过一系列处理后分别在两个电极生成产品“MnO2和锌”。工艺流程如下:
已知:Ⅰ:金属硫化物、硫酸、二氧化锰三者发生的反应均是氧化还原反应。
例如:MnO2+ZnS+2H2SO4![]() MnSO4+ZnSO4+S+2H2O.
MnSO4+ZnSO4+S+2H2O.
Ⅱ:4X-+Mn2+![]() MnX42-,X-不参与电极反应。Zn2+与X-不反应。
MnX42-,X-不参与电极反应。Zn2+与X-不反应。
Ⅲ:各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | A13+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)操作I的名称是_____________________。
(2)物质C是MnO2和ZnO的混合物。加入物质C充分作用后,过滤,所得固体的成分是________(用化学式表示)。
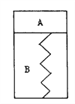
(3)电解溶液D的装置如下图所示,两个电极都是惰性电极。
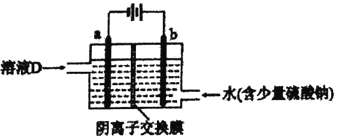
①硫酸钠的作用是________________________。
②b电极的电极反应式是______________________。a电极的电极反应式是_______________________。
(4)若一定质量的闪锌矿中含1.76kgFeS,则在上述流程中1.76kgFeS消耗MnO2的质量为_______kg。
(5)现有0.4mol/L Mn(NO3)2、 0.8mol/LZn(NO3)2的混合溶液100mL,向该混合液中逐滴加入Na2S溶液,当MnS沉淀一定程度时,测得c(Mn2+)=2.0×10-3 mol/L,则此时c(Zn2+)=________[已知Ksp(ZnS)=1.3×10-24,Ksp(MnS)=2.6×10-13]
【答案】 过滤 Al(OH)3和Fe(OH)3 增强溶液的导电性 Mn2+-2e-+2H2O=MnO2+4H+ Zn2+ +2e- = Zn 2.61 1.0×10-14mol/L
【解析】由题中信息可知,向软锰矿和闪锌矿中加入硫酸发生氧化还原反应,过滤后得到的固体A为单质S和SiO2,溶液A中含有Mn2+、Zn2+、Al3+、Fe3+、Cu2+、H+等,向溶液A中加入金属锌得到酸性溶液B,说明溶液A中的H+未完全反应,则Zn只和Fe3+、Cu2+、H+反应,所得固体B为Cu,溶液B中含有Mn2+、Zn2+、Al3+、Fe2+、H+等,向溶液B中加入物质C,C为MnO2和ZnO的混合物,在酸性条件下MnO2将Fe2+氧化成Fe3+,调节溶液pH,Al3+、Fe3+生成Al(OH)3、Fe(OH)3沉淀,过滤后除去,将滤液浓缩后加入试剂NaX得溶液D,电解得产品MnO2和锌。
(1). 将固体A和溶液A分离的操作为过滤,故答案为:过滤;
(2). 由上述分析可知,向溶液B中加入物质C调节溶液pH,可以将Al3+、Fe3+生成Al(OH)3、Fe(OH)3沉淀而除去,故答案为:Al(OH)3和Fe(OH)3;
(3). ①. 电解时加入少量硫酸钠,可以增强溶液的导电性,故答案为:增强溶液的导电性;
②. 由电解装置图可知,b为电解池的阳极,Mn2+在阳极失电子生成MnO2,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+,a为电解池的阴极,Zn2+在阴极得电子生成单质Zn,电极反应式为Zn2+ +2e- = Zn,故答案为:Mn2+-2e-+2H2O=MnO2+4H+;Zn2+ +2e- = Zn;
(4). 根据题中信息可知,酸性条件下FeS与MnO2发生的化学方程式为:3MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S+6H2O,根据反应方程式有:3MnO2~2FeS,则1.76kgFeS消耗MnO2的质量为: ![]() = 2.61kg,故答案为:2.61;
= 2.61kg,故答案为:2.61;
(5). 向Mn(NO3)2、Zn(NO3)2的混合溶液中逐滴加入Na2S溶液,当MnS沉淀一定程度时,测得c(Mn2+)=2.0×10-3 mol/L,则溶液中c(S2-)= 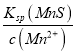 =
=![]() mol/L=1.3×10-10 mol/L,此时c(Zn2+)=
mol/L=1.3×10-10 mol/L,此时c(Zn2+)= =
=![]() mol/L=1.0×10-14mol/L,故答案为:1.0×10-14mol/L。
mol/L=1.0×10-14mol/L,故答案为:1.0×10-14mol/L。

 名校课堂系列答案
名校课堂系列答案【题目】2017年,中科院大连化学物理研究所碳资源小分子与氢能利用创新特区研究组(DNL19T3)孙剑、葛庆杰研究员团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1) 工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_____________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是_________________。
(2) 该研究成果用CO2制取高辛烷值汽油的路线是先将CO2按逆水煤气反应生成CO,然后由CO与H2反应生成烃,产物中汽油组分占所有烃类产物的百分比近80%。
① 已知:H2 (g)+![]() O2 (g) === H2O(l) ΔH1= —285.8 kJ·mol-1
O2 (g) === H2O(l) ΔH1= —285.8 kJ·mol-1
C8H18(l)+![]() O2(g) === 8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1
O2(g) === 8CO2(g)+9H2O(l) ΔH3= —5518 kJ·mol-1
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方
程式__________________________。
② 在一实验容器中充入一定量的CO2和H2,若加入催化剂恰好完全反应,且产物只生成C5以上的烃类物质和水,则CO2与H2的物质的量之比不低于________。
(3) 二甲醚(CH3OCH3)的十六烷值高,燃烧尾气中污染物少,可代替柴油。CO、CO2混合加氢的方法是在一个反应器中将合成气直接转化为二甲醚,包括以下4个反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ①
CH3OH(g)+H2O(g) ①
CO2(g)+H2(g)![]() CO(g)+H2O(g) ②
CO(g)+H2O(g) ②
CO(g)+2H2(g)![]() CH3OH(g) ③
CH3OH(g) ③
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ④
CH3OCH3(g)+H2O(g) ④
① 已知反应④在某温度下的平衡常数为K=400。此温度下,在一恒容密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
此时正、逆反应速率的大小:v(正) ______ v(逆) (填“>”、“<”或“=”)。
若加入CH3OH后,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=_____。
② 某科研小组在反应温度503K~543K,反应压强分别是3、4、5、6、7MPa,n(CO)/n(CO+CO2)=0.5的情况下计算了二甲醚的平衡收率(二甲醚实际产量与反应物总量之比),结果如图1所示。

a~e曲线分别对应不同的压强条件,则e对应的压强是______,理由是___________。
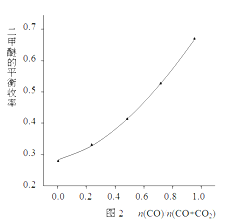
该科研小组在反应温度523K、反应压强5MPa的条件下,按照合成反应的化学计量比进料,改变n(CO)/n(CO+CO2)的比例,二甲醚的平衡收率的变化规律如图2所示。
由图2可知,二甲醚的平衡收率随着n(CO)/n(O+CO2)比值的增大而单调上升,其原因是________________________________________________。