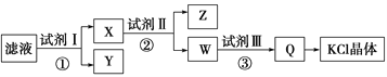
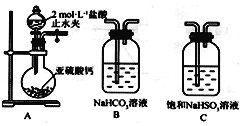
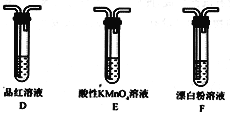
题目内容
【题目】H2C2O4为二元弱酸。常温下0.1mol·L-1 NaHC2O4溶液(pH约为4)中指定微粒的物质的量浓度关系错误的是
A. c(Na+)= c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)
)+c(H2C2O4)
B. c(HC2O4-)>c(H2C2O4)>c(C2O![]() )
)
C. c(Na+)+c(H+)=c(HC2O![]() )+ c(C2O
)+ c(C2O![]() )+c(OH-)
)+c(OH-)
D. c(H2C2O4)+c(H+)=c(C2O![]() )+c(OH-)
)+c(OH-)
【答案】BC
【解析】利用溶液中的三大守恒进行分析判断。
A.根据物料守恒有 c(Na+)= c(HC2![]() )+c(C2
)+c(C2![]() )+c(H2C2O4),选项A正确;B. 溶液pH约为4说明HC2
)+c(H2C2O4),选项A正确;B. 溶液pH约为4说明HC2![]() 的电离大于水解,故c(C2
的电离大于水解,故c(C2![]() )>c(H2C2O4),选项B错误;C. 根据电荷守恒有c(Na+)+c(H+)= c(HC2
)>c(H2C2O4),选项B错误;C. 根据电荷守恒有c(Na+)+c(H+)= c(HC2![]() )+ 2c(C2
)+ 2c(C2![]() )+c(OH-),选项C错误;D. 根据质子守恒有c(H2C2O4)+c(H+) = c(C2
)+c(OH-),选项C错误;D. 根据质子守恒有c(H2C2O4)+c(H+) = c(C2![]() )+c(OH-),选项D正确。答案选BC。
)+c(OH-),选项D正确。答案选BC。

练习册系列答案
相关题目