题目内容
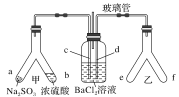
【题目】某校化学兴趣小组对SO2的性质和回收利用等问题进行探究,对环境保护具有重要意义。SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸。选择下面的装置和药品来探究亚硫酸与次氯酸的酸性强弱。
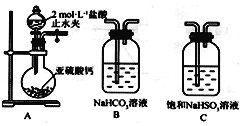
(1)装置A中盛放亚硫酸钙的仪器名称是_________________,其中发生反应的化学方程式为_____________________________________________________;
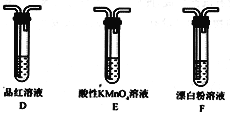
(2)装置正确的连接顺序为A→____→ → → D → F ,其中装置B的作用是_________。证明亚硫酸的酸性强于次氯酸的现象为________________________________________。
【答案】圆底烧瓶CaSO3+2HCl=CaCl2+SO2↑+H2OC B E制取CO2D中品红溶液不褪色,F中出现白色沉淀
【解析】
(1)装置A中盛放亚硫酸钙的仪器为圆底烧瓶,发生反应的化学方程式为 CaSO3+2HCl=CaCl2+SO2↑+H2O。(2) 次氯酸具有强氧化性,二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸和次氯酸的酸性强弱,应先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比次氯酸酸性强弱进行判断。装置A制备二氧化硫,由于盐酸有挥发性,制备的二氧化硫中含有氯化氢,用饱和的亚硫酸氢钠除去氯化氢,再通过碳酸氢钠溶液,可以验证亚硫酸的酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中 的二氧化硫,用品红溶液检验二氧化碳中的二氧化硫是否除尽,再通入F中。所以仪器的连接顺序为:A、C、B、E、D、F。装置B是用二氧化硫和碳酸氢钠反应制取CO2 。二氧化硫和碳酸氢钠反应生成二氧化碳,二氧化碳和次氯酸钙反应生成碳酸钙白色沉淀,D中品红溶液不褪色,F中出现白色沉淀,证明了碳酸反应生成次氯酸,证明碳酸酸性比次氯酸酸性强,进而证明亚硫酸的酸性比次氯酸的酸性强。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案