题目内容
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )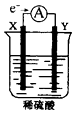
A.X极上发生的是还原反应
B.若两电极分别为Fe和碳棒,则Y为Fe
C.若反应进行一段时间后,产生2克H2时转移了1mol电子
D.溶液中的SO42-向X极移动
【答案】D
【解析】解:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,则A、根据电子的流向可知X是负极,发生失去电子的氧化反应,A不符合题意;
B、铁是活泼的金属,则X电极是铁,Y电极是碳棒,B不符合题意;
C、2g氢气是1mol,转移2mol电子。C不符合题意;
D、原电池中阴离子向负极即向X电极移动,D符合题意。
故答案为:D
本题通过原电池图形考察了与原电池有关的相关内容。原电池中较活泼的金属作负极;原电池判断反应根据(负氧正还);正离子的流动方向是由负极到正极;负离子的流动方向是由正极到负极

 阅读快车系列答案
阅读快车系列答案【题目】硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示: 
已知某些氢氧化物沉淀的pH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
(1)MgO的电子式为 .
(2)滤渣2的主要成分是 , 向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 .
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 .
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4 , 可以使烟气脱硫,该反应的化学方程式为 .
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为(用含有a、b的代数式表示).