题目内容
【题目】按要求回答下列问题:.
(1)室温下,用0.1mol/LNaOH溶液滴定20.00mL浓度为0.1mol/L的HA酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图:
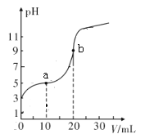
①a点对应的溶液中c(HA)____c(A-)(选填“>”“<”或“=”);b点对应的溶液中各离子浓度由大到小的顺序为_________。
②K(HA)=_________。
(2)已知:T℃时,Kw=1×10-12。在T℃时,将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(注:混合后溶液体积等于混合前两溶液体积之和)。若所得混合溶液的pH=3,则a:b=_________。
【答案】< c(Na+)>c(A-)>c(OH-)>c(H+) 1.0×10-5 9:2
【解析】
(1)根据图像起点,HA的pH=3,说明HA为弱酸,①a点溶质为HA和NaA,且两者物质的量相等,溶液显酸性,即有c(HA)<c(A-);b点溶质为NaA,A-发生水解,溶液显碱性,即离子浓度大小顺序是c(Na+)>c(A-)>c(OH-)>c(H+);
②通过起点进行分析,c(H+)=10-3mol·L-1,K(HA)=c(A-)×c(H+)/c(HA)=10-3×10-3/0.1=10-5;
(2)此温度下,NaOH溶液中c(OH-)=10-3mol·L-1,反应后溶液显酸性,因此有(bL×10-2mol·L-1-aL×10-3mol·L-1)/(aL+bL)=10-3mol·L-1,a:b=9:2。

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D