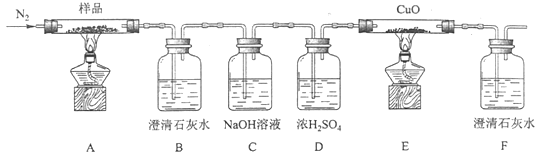
题目内容
【题目】工业上合成CH3OH的原理为:2H2(g)+CO![]() CH3OH(g),一定温度下,向1L恒容密闭容器中充入H2和CO,反应达平衡时CH3OH的体积分数与反应物投料之比(n(H2)/n(CO))的关系如图所示。下列说法错误的是
CH3OH(g),一定温度下,向1L恒容密闭容器中充入H2和CO,反应达平衡时CH3OH的体积分数与反应物投料之比(n(H2)/n(CO))的关系如图所示。下列说法错误的是
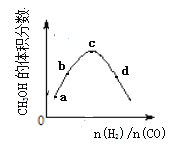
A. 相同条件下,达到平衡时混合气体的密度与反应前相同
B. a、b、c、d四点中,c点CO的转化率最大。
C. 若投料时n(CO)不变,a、b、c、d四点中d处CH3OH的物质的量最大
D. 图像中 c点到d点,平衡向正反应方向移动
【答案】B
【解析】
A、容器为恒定,气体体积不变,组分都是气体,气体质量不变,因此任何时刻气体密度都想等,即达到平衡时气体的密度与反应前相同,故A说法正确;
B、投料比增大,增大氢气的物质的量,平衡向正反应方向进行,CO的转化率增大,即四个点中d点CO的转化率最大,故B说法错误;
C、根据B选项分析,增大H2的量,平衡向正反应方向进行,甲醇的物质的量增大,即四点中d处CH3OH的物质的量最大,故C说法正确;
D、c点到d点,增加了H2的量,平衡向正反应方向进行,故D说法正确。

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目