题目内容
【题目】写出解释下列事实的离子方程式:
(1)FeCl3水溶液呈酸性:_________
(2)用Na2CO3溶液浸泡含有CaSO4的水垢:_________
(3)用稀硫酸酸化的KI淀粉溶液在空气中久置后变蓝:__________
【答案】Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+ CaSO4(s) + CO32-(aq)
Fe(OH)3 + 3H+ CaSO4(s) + CO32-(aq)![]() CaCO3(s) + SO42-(aq) 4I-+ O2 + 4H+=2I2 + 2H2O
CaCO3(s) + SO42-(aq) 4I-+ O2 + 4H+=2I2 + 2H2O
【解析】
(1)FeCl3为强酸弱碱盐,Fe3+发生水解,其水解方程式为Fe3++3H2O![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
(2)CaCO3为难溶物,CaSO4为微溶物,即有CO32-(aq)+CaSO4(s)=CaCO3(s)+SO42-(aq);
(3)I-具有强还原性,容易被氧气氧化,离子方程式为4I-+O2+4H+=2I2+2H2O。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+ 6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡。下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol·L-1) | 物质的平衡浓(mol·L-1) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 0.60 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(C2H5OH ,甲)﹦c(C2H5OH ,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
【题目】用含FeCl2杂质的氯化铜晶体制纯净CuCl2·2H2O的过程是:先将晶体配制成水溶液,然后按如下图步骤进行提纯:
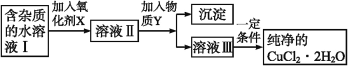
已知:在上述流程条件下,Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______。得到溶液II,最适合作氧化剂X的是______(选填以下编号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)为了除去Fe3+,需加入物质Y调节溶液的pH范围是_________________
(3)溶液Ⅲ得到CuCl2·2H2O晶体的操作是:蒸发浓缩,冷却结晶,____,___,干燥。