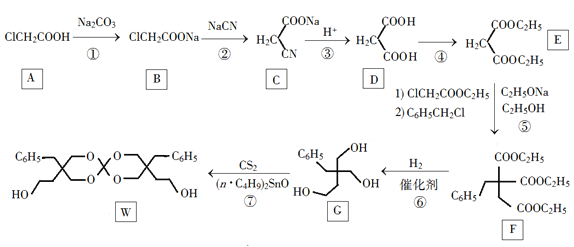
题目内容
【题目】完成下列计算(注意单位)
(1)在标准状况下,1.7 g氨气所占的体积约为_________L,它与同条件下_____mol H2S含有相同的氢原子数。
(2)在标准状况下,0.5 mol任何气体的体积都约为________ L。
(3)4 g H2与22.4 L(标准状况)CO2相比,所含分子数目较多的是________。
(4)0.01 mol某气体的质量为0.28 g,该气体的摩尔质量为________。
(5)0.3 mol NH3分子中所含氢原子数与____________个H2O分子中所含氢原子数相等。
(6)含0.4 mol Al3+的Al2(SO4)3中所含的SO![]() 的物质的量是________mol。
的物质的量是________mol。
(7)2.3 g Na中含电子的物质的量为___________mol,在跟足量水反应中失去电子的物质的量为____________mol。
【答案】2.24L 0.15mol 11.2L H2 28g·mol-1 2.709×1023 0.6 1.1 0.1
【解析】
(1)在标准状况下,1.7 g氨气所占的体积约为![]() =2.24 L,它与同条件下
=2.24 L,它与同条件下![]()
![]() =0.15mol H2S含有相同的氢原子数。故答案为:2.24L;0.15mol;
=0.15mol H2S含有相同的氢原子数。故答案为:2.24L;0.15mol;
(2)在标准状况下,0.5 mol任何气体的体积都约为![]() =11.2 L。故答案为:11.2L ;
=11.2 L。故答案为:11.2L ;
(3)n(H2)=4g÷2g·mol-1=2mol,V(H2)=2mol×22.4L·mol-1=44.8L,N(H2)=2NA,n(CO2)=22.4L÷22.4L·mol-1=1mol,N(CO2)=NA,则所含分子数多的是H2,故答案为:H2;
(4)0.01 mol某气体的质量为0.28 g,该气体的摩尔质量为![]() =28g·mol-1。故答案为:28g·mol-1;
=28g·mol-1。故答案为:28g·mol-1;
(5)0.3 mol NH3含有0.9molH ,2×n(H2O)=0.9mol, n(H2O)=0.45mol, N=0.45molNA=2.709×1023,0.3 mol NH3分子中所含氢原子数与2.709×1023个H2O分子中所含氢原子数相等。故答案为:2.709×1023;
(6)由物质的构成可知,n(SO42-)=![]() n(Al3+)=
n(Al3+)=![]() ×0.4mol=0.6mol,故答案为:0.6;
×0.4mol=0.6mol,故答案为:0.6;
(7)2.3g Na的物质的量为2.3g÷23g·mol-1=0.1mol,含有电子物质的量为0.1mol×11=1.1mol,Na与水反应生成NaOH与氢气,反应中Na失去电子为0.1mol×1=0.1mol,
故答案为:1.1;0.1;