题目内容
17.几种短周期元素的原子半径及主要化合价见表:根据表中信息,判断以下说法正确的是( )| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 离子的还原性:T2->Z2- | |
| B. | 离子半径:Z2->X2+ | |
| C. | Y的原子序数大于X | |
| D. | X和Y的最高价氧化物的水化物的碱性:Y>X |
分析 短周期元素,X、Y都有+2价,处于ⅡA族,原子半径X>Y,则X为Mg、Y为Be;Z、T都有-2价,而Z有-2、+6价,可推知Z为S元素、T为O元素;R有+3价,处于ⅢA族,原子半径大于S,则R为Al,结合元素周期律解答.
解答 解:短周期元素,X、Y都有+2价,处于ⅡA族,原子半径X>Y,则X为Mg、Y为Be;Z、T都有-2价,而Z有-2、+6价,可推知Z为S元素、T为O元素;R有+3价,处于ⅢA族,原子半径大于S,则R为Al.
A.非金属性O>S,故离子还原性:O2-<S2-,故A错误;
B.电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Mg2+,故B正确;
C.X为Mg、Y为Be,X的原子序数大于Y,故C错误;
D.金属性Mg>Be,故碱性Mg(OH)2>Be(OH)2,故D错误,
故选B.
点评 本题考查元素位置结构和性质的关系及应用,侧重对元素周期律的考查,题目难度中等,根据原子半径和元素化合价推断元素是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.区别棉花和羊毛最简便的方法是( )
| A. | 加稀硫酸水解 | B. | 浸入水中 | C. | 加入碘水 | D. | 火上灼烧闻气味 |
5.分子式为C7H2402的有机物Q,在稀硫酸存在下能发生反应生成M、N,其中M的相对分子质量为60,下列有关说法中一定正确的是( )
| A. | Q可能有8种同分异构体 | B. | Q不可能有4种同分异构体 | ||
| C. | N只有2种同分异构体 | D. | M只有4种同分异构体 |
2.对于反应A(g)+3B(g)?2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的速率,其中最快的是( )
| A. | v(D)=0.4mol/(L•S) | B. | v(C)=0.5mol/(L•S) | C. | v(B)=0.6mol/(L•S) | D. | v(A)=0.15mol/(L•S) |
9.下列不属于影响离子晶体结构的因素是 ( )
| A. | 晶体中阴、阳离子的半径比 | B. | 离子晶体的晶格能 | ||
| C. | 晶体中阴、阳离子的电荷比 | D. | 离子键的纯粹程度 |
6.下列各对物质中,互为同系物的是( )
| A. | CH3-CH3和CH3-CH=CH2 | B. | CH3-CH=CH2和CH3-CH2-CH=CH2 | ||
| C. | 乙醇和丙三醇 | D. | 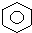 和 和  |
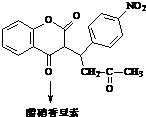
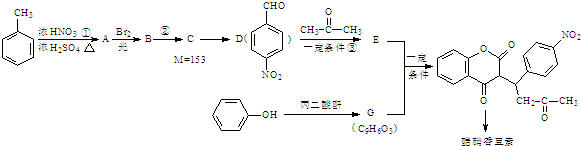
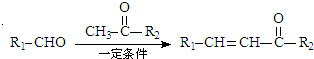 +H2O
+H2O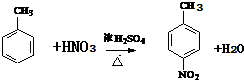 .
.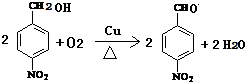 .
.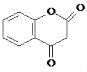 .
.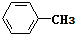 互为同系物;
互为同系物; .
.