题目内容
某溶液中大量存在以下五种离子: Cl 、SO42-、Fe3+、H+、M,其物质的量浓度之比
、SO42-、Fe3+、H+、M,其物质的量浓度之比
为c(Cl )︰c(SO42—)︰c(Fe3+)︰c(H
)︰c(SO42—)︰c(Fe3+)︰c(H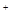 )︰c(M)=5︰3︰2︰3︰2,则M可能是( )
)︰c(M)=5︰3︰2︰3︰2,则M可能是( )
| A.Ag+ | B.Mg2+ | C.NO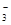 | D.Na+ |
D
解析试题分析:根据溶液中正电荷总数+负电荷总数="0"
5×Cl-+3×SO42- =2×Fe3++3×H++2×M
5+6=6+3+2M
M=1
即,M为+1价的阳离子选项中,AD符合但,Ag+和Cl 会结合生成AgCl、无法大量共存。所以,唯一符合要求的是Na+故选D
会结合生成AgCl、无法大量共存。所以,唯一符合要求的是Na+故选D
考点:离子共存

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
对某酸性溶液(可能含有Br―,SO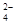 ,H2SO3,NH
,H2SO3,NH )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是 ( )
| A.Br― | B.SO42- | C.H2SO3 | D.NH4+ |
下列离子方程式书写正确的是
| A.澄清的石灰水与醋酸反应:OH-+CH3COOH=CH3COO-+H2O |
| B.碳酸钙与盐酸反应:CO2-3+2H+=CO2↑+H2O |
| C.钠与水反应:Na++H2O=Na++OH-+H2↑ |
| D.铜片与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
有甲、乙、丙三种溶液,进行如下操作: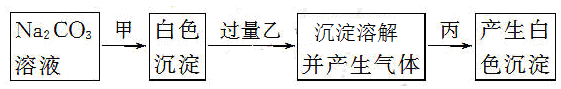
则甲、乙、丙三种溶液可能是
| A.BaCl2、H2SO4、MgCl2 | B.CaCl2、HNO3、BaCl2 |
| C.CaCl2、HNO3、NaCl | D.BaCl2、HCl、Na2SO4 |
不能用H+ + OH- = H2O离子方程式表示的化学反应是
| A.盐酸和氢氧化钾溶液的反应 | B.硝酸和氢氧化铜溶液的反应 |
| C.盐酸和澄清石灰水的反应 | D.硫酸和氢氧化钠溶液反应 |
下列电离方程式错误的是
| A.NaHCO3=Na++ H+ + CO32- | B.NaOH=Na+ + OH- |
| C.H2SO4=2H+ + SO42- | D.KCl=K+ + Cl- |
无色透明溶液中,可以大量共存的是
| A.Ca2+、Na+、NO3-、SO42- | B.HCO3-、Na+、Cl-、H+ |
| C.Mg2+、Cl-、Cu2+、SO42- | D.K+、Ba2+、Cl-、NO3- |
除去NaCl溶液中的SO42-离子,依次加入的溶液顺序正确的是
| A.Na2CO3、HCl、 BaCl2 | B.BaCl2、HCl、Na2CO3 |
| C.Na2CO3、BaCl2、HCl | D.BaCl2、Na2CO3、HCl |
下列离子方程式书写正确的是
| A.用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+= Cu2++2H2O |
B.实验室制氯气:MnO2+4HCl(浓) 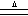 Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| C.用FeS除去工业废水中的Hg2+:Hg2++S2-=HgS↓ |
| D.向次氯酸钠溶液中通入少量二氧化硫:ClO-+ SO2 + H2O = Cl-+SO42- + 2H+ |