题目内容
下列离子方程式书写正确的是
| A.用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+= Cu2++2H2O |
B.实验室制氯气:MnO2+4HCl(浓) 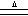 Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| C.用FeS除去工业废水中的Hg2+:Hg2++S2-=HgS↓ |
| D.向次氯酸钠溶液中通入少量二氧化硫:ClO-+ SO2 + H2O = Cl-+SO42- + 2H+ |
A
解析试题分析:A选项正确。B选项浓盐酸与二氧化锰共热反应的离子方程式为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,故B错误。C选项,FeS为难溶物,电离方程式不能拆分,错误。D选项,向次氯酸钠溶液中通入少量二氧化硫离子方程式应为SO2+2ClO- ="=" SO42-+Cl2
Mn2++Cl2↑+2H2O,故B错误。C选项,FeS为难溶物,电离方程式不能拆分,错误。D选项,向次氯酸钠溶液中通入少量二氧化硫离子方程式应为SO2+2ClO- ="=" SO42-+Cl2
考点:离子方程式书写

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某溶液中大量存在以下五种离子: Cl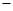 、SO42-、Fe3+、H+、M,其物质的量浓度之比
、SO42-、Fe3+、H+、M,其物质的量浓度之比
为c(Cl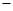 )︰c(SO42—)︰c(Fe3+)︰c(H
)︰c(SO42—)︰c(Fe3+)︰c(H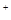 )︰c(M)=5︰3︰2︰3︰2,则M可能是( )
)︰c(M)=5︰3︰2︰3︰2,则M可能是( )
| A.Ag+ | B.Mg2+ | C.NO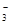 | D.Na+ |
下列各组离子在指定溶液中能大量共存的是
| A.无色溶液中:K+、Na+、MnO4-、SO42- |
| B.含大量Fe2+溶液中:K+、Cl-、NO3-、Na+ |
| C.加入Al能产生H2的溶液中:I-、NO3-、SO42-、NH4+ |
| D.在酸性溶液中:NH4+、Na+、Cu2+、ClO- |
能正确表示下列反应的离子方程式是
| A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3 + 6H+ + 2I-=2Fe2+ + I2 +3H2O |
| B.铝粉与NaOH溶液反应:2Al + 2OH-=2AlO2-+ H2↑ |
| C.5.6 g Fe与200 mL 2.0 mol/L HNO3溶液充分反应:3Fe + 2NO3-+ 8H+=3Fe2+ + 2NO↑ + 4H2O |
D.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
下列各组微粒在指定环境中一定可大量共存的是
A.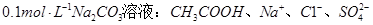 |
B.常温下,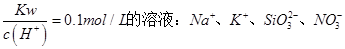 |
C.投入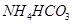 固体能产生气体的溶液: 固体能产生气体的溶液: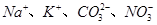 |
D.pH=1的溶液中: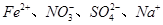 |
能在溶液中大量共存的一组离子是
| A.NH4+、Ca2+、SO42-、CO32- | B.Fe3+、H+、I-、HCO3- |
| C.K+、Na+、H+、NO3-、MnO4- | D.Al3+、Mg2+、SO42-、CO32- |
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
| A.Na+、K+、OH-、Cl- | B.Na+、Cu2+、SO42-、NO3- |
| C.Mg2+、Na+、SO42-、Cl- | D.Ba2+、HCO3-、NO3-、K+ |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- |
| B.0.1mol·L-1HNO3溶液: Na+、Mg2+、SO42-、Cl- |
| C.0.5mol·L-1FeCl3溶液:K+、Na+、I-、SO42- |
| D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3- |