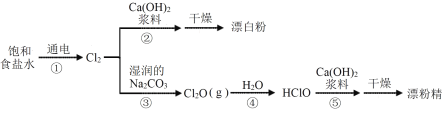
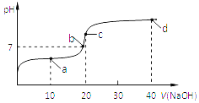
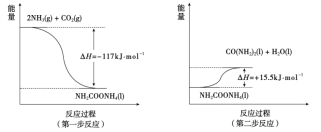
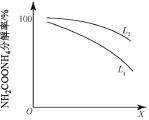
题目内容
【题目】在盛有1L0.1mol/LCuSO4溶液的大烧杯中,用锌、铜作电极,用导线连接形成原电池,当电极锌消耗3.25g时,试完成:
(1)写出电极反应式:负极__________________;正极____________。
(2)电极上析出铜的质量。__________________
【答案】Zn-2e-=Zn2+ Cu2++2e-=Cu 3.2g
【解析】
(1)用锌、铜作电极,锌较活泼,为原电池的负极,发生氧化反应,正极铜离子发生还原反应;
(2)结合物质的物质的量以及电极方程式计算。
(1)用锌、铜作电极,锌较活泼,为原电池的负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,正极发生还原反应,电极方程式为:Cu2++2e-=Cu,
故答案为:Zn-2e-=Zn2+;Cu2++2e-=Cu;
(2)n(Zn)=![]() =0.05mol,
=0.05mol,
负极发生Zn-2e-=Zn2+,可失去0.1mol电子,正极发生Cu2++2e-=Cu,Cu2+得到0.1mol电子,生成的铜为0.05mol,质量为0.05mol×64g·mol-1=3.2g,故答案为:3.2。

【题目】在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3- CO32- SiO32- SO42- |
提示:SiO32-+2H+=H2SiO3↓(H2SiO3是白色沉淀)、H2SiO3![]() SiO2+H2O
SiO2+H2O
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的阳离子是______,一定不存在的阴离子是________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)
阴离子 | ①___ | ②___ | ||
c/mol·L-1 | ____ | ___ |
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_______________。