题目内容
【题目】为了解决能源的可再生及将CO2变废为宝等问题,科学家借鉴自然界的光合作用原理,通过“人工” 光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如下图所示。 请回答:
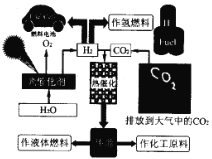
(1) 联系自然界的光合作用原理,并结合上述图示, 写出“人工”光合作用的化学方程式;______;在图示转化过程中,太阳能除了储存在甲醇中,还储存在_____中(填化学式)。
(2)图中热催化过程的反应原理为CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)△H。
已知:2H2(g)+O2(g)=2H2O (g)△H1= -483.6 kJmo1-1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1352.86 kJmol-1
△H =_____________。
(3)实验室对热催化反应进行模拟探究:一定温度下,向容积均为2 L 的恒容密闭容器中分别通入1.0 mol CO2(g)和3.0 mol H2(g), 在不同催化剂X、Y 的催化下发生反应。测得5 min时,CO2转化率与温度的变化关系如图所示。
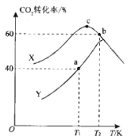
①该反应适宜选用的催化剂为__________(填“X'”或 “Y”)。
②T1K时,a点对应容器在0~5 min内的平均反应速率v(H2)=______;b、c点对应状态下反应物的有效碰撞几率b______c(填“>”“<”或“=”),原因为___________。
③T2K时,若反应前容器内的压强为p, 则该温度下反应的平衡常数KP=_________。 (KP为用分压表示的平衡常数)。
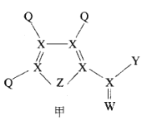
(4)我国化学家结合实验和计算机模拟结果,研究得出热催化反应的一种可能历程如图所示,其中自由基用“”标出,过渡态用TS表示。
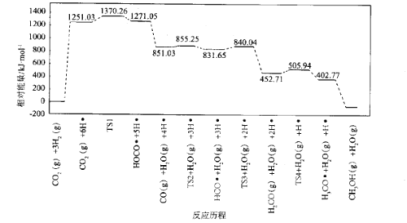
四个过渡态中对反应速率影响最大的是____,理由为____;该步骤的化学方程式为____。
【答案】2CO2+4H2O![]() 2CH3OH+3O2或2H2O
2CH3OH+3O2或2H2O![]() 2H2+O2、CO2+3H2
2H2+O2、CO2+3H2![]() CH3OH+H2O H2 -48.97 kJ· mo1-1 X 0.12 mol-1min-1 > b点比c点对应状态下反应物浓度大,体系温度高
CH3OH+H2O H2 -48.97 kJ· mo1-1 X 0.12 mol-1min-1 > b点比c点对应状态下反应物浓度大,体系温度高 ![]() TS1 该步反应的活化能(或能垒或需要吸收的能量)最大 CO2+6H=HOCO+5H或CO2+H=HOCO
TS1 该步反应的活化能(或能垒或需要吸收的能量)最大 CO2+6H=HOCO+5H或CO2+H=HOCO
【解析】
根据液态太阳燃料的合成示意图分析反应过程;根据盖斯定律计算热催化过程的ΔH,结合转化率图像选择合适的催化剂,并根据公式![]() 计算反应速率,根据三段式计算压强平衡常数,根据图像分析写出化学方程式。
计算反应速率,根据三段式计算压强平衡常数,根据图像分析写出化学方程式。
(1)由液态太阳燃料的合成示意图分析可知,排放在空气中的CO2与H2O电解产生的H2在太阳能的条件下发生反应生成CH3OH,反应的化学方程式为2CO2+4H2O![]() 2CH3OH+3O2或2H2O
2CH3OH+3O2或2H2O![]() 2H2+O2、CO2+3H2
2H2+O2、CO2+3H2![]() CH3OH+H2O,则太阳能出来储存在甲醇中,还储存在H2中,故答案为:2CO2+4H2O
CH3OH+H2O,则太阳能出来储存在甲醇中,还储存在H2中,故答案为:2CO2+4H2O![]() 2CH3OH+3O2或2H2O
2CH3OH+3O2或2H2O![]() 2H2+O2、CO2+3H2
2H2+O2、CO2+3H2![]() CH3OH+H2O;H2;
CH3OH+H2O;H2;
(2)根据题干信息,![]() (3×反应1-反应2)可得反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g),根据盖斯定律可得
(3×反应1-反应2)可得反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g),根据盖斯定律可得![]() ,故答案为:-48.97;
,故答案为:-48.97;
(3)①根据图像可知,相同温度时选用催化剂X时,CO2的转化率较高,故答案为:X;
②由图像,T1K时,a点对应容器在0~5 min内CO2的转化率为40%,则Δn(CO2)=1.0mol×40%=0.4mol,根据方程式CO2(g)+3H2(g)=CH3H(g)+H2O(g)可知,Δn(H2)=3Δn(CO2)=1.2mol,则平均反应速率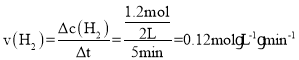 ,由于b点比c点对应状态下反应物浓度大,体系温度高,所以b点对应状态下反应物的有效碰撞几率b>c,故答案为:0.12 mol-1min-1;>;b点比c点对应状态下反应物浓度大,体系温度高;
,由于b点比c点对应状态下反应物浓度大,体系温度高,所以b点对应状态下反应物的有效碰撞几率b>c,故答案为:0.12 mol-1min-1;>;b点比c点对应状态下反应物浓度大,体系温度高;
③由图像可知,T2K时CO2的转化率为60%,即Δn(CO2)=1.0mol×60%=0.6mol,则可列三段式:
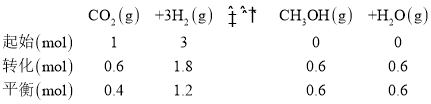
由阿伏加德罗定律PV=nRT可知,恒温恒容时,压强与物质的量成正比,因此反应后的总压强为0.7p,则该温度下反应的平衡常数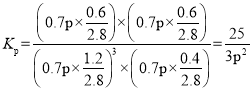 ,故答案为:
,故答案为:![]() ;
;
(4)由热催化反应的历程图分析可知,TS1步反应的活化能(或能垒或需要吸收的能量)最大,对反应速率的影响最大,反应方程式为CO2+6H=HOCO+5H或CO2+H=HOCO,故答案为:TS1;该步反应的活化能(或能垒或需要吸收的能量)最大;CO2+6H=HOCO+5H或CO2+H=HOCO。