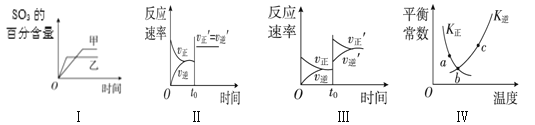
��Ŀ����
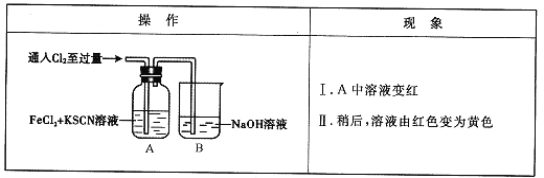
����Ŀ������������(Na2S2O3)�dz��õ�ʳƷ��������֮һ���ڿ����б��������ɵIJ���ΪNa2SO4.ijС���������ʵ�飺
ʵ��һ ���������Ƶ���ȡ
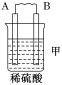
������ͼװ��(ʵ��ǰ�ѳ���װ���ڵĿ���)��ȡNa2S2O5��װ��II����Na2S2O5���������������ķ�ӦΪ��Na2SO3+SO2=Na2S2O5
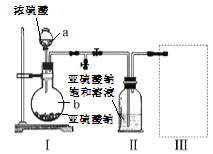
��1������a��b�����Ʒֱ���_________��__________��
��2��װ��I�в�������Ļ�ѧ����ʽΪ__________��
��3��Ҫ��װ��II�л���������ľ��壬�ɲ��õķ��뷽����__________���÷����õ��IJ����������ձ���©������___________��
��4��װ��III���ڴ���β������ѡ�õ������װ��(�г���������ȥ)Ϊ_________(�����)��

ʵ��� ���������Ƶ�����
Na2S2O5����ˮ������NaHSO3
��5��NaHSO3��Һ��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ��ɲ��õ�ʵ�鷽����_________(�����)��
A���ⶨ��Һ��pH
B������Ba(OH)2��Һ
C����������
D������Ʒ����Һ
E.����ɫʯ����ֽ���
��6������Na2S2O5�����ڿ������ѱ�������ʵ�鷽����________��
���𰸡�
��1����Һ©����Բ����ƿ��
��2��Na2SO3+H2SO4=Na2SO4+SO2��+H2O��
��3�����ˡ���������
��4��d��
��5��a��e��
��6��ȡ����Na2S2O5�������Թ��м�������ˮ��Һ���μ������������ٵ����Ȼ�����Һ���а�ɫ�������ɡ�
��������
�����������1������װ��ͼ������aΪ��Һ©����bΪԲ����ƿ���ʴ�Ϊ����Һ©����Բ����ƿ��
��2����װ�����з����ķ�Ӧ��֪��װ�����в���������ΪSO2���������������ᷴӦ���������ơ�����������ˮ����Ӧ����ʽΪ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O���ʴ�Ϊ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O��
��3��װ�����л���������ľ��壬���������Һ̬��Ӧ��ȡ���˽��з��룬���˳��ձ���©�����貣�������ʴ�Ϊ�����ˣ���������
��4��a��װ��Ӧ���������백ˮ�п������ն�������Ϊ�ܱջ�����װ����ѹǿ�����ײ�����ȫ�¹ʣ��ʴ���b����װ�����ն������������ϲ��Ϊ�ܱջ�����װ����ѹǿ�����ײ�����ȫ�¹ʣ��ʴ���c����װ�ò������ն�������������ʵ��ʵ��Ŀ�ģ��ʴ���d����װ���������������������Ӧ���������գ��ҷ�ֹ����������ȷ���ʴ�Ϊ��d��
��5��NaHSO3��Һ��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ���Һ�����ԣ��ⶨ��Һ��pH������ȷ����Һ����ԣ�������Һ����ʹʪ����ɫʯ����ֽ��죬�������òⶨ��ҺpHֵ��ʪ�����ɫʯ����Һ���飬������Ba(OH)2��Һ��HCl��Һ��Ʒ����Һ������˵����Һ�����ԣ���ѡae���ʴ�Ϊ��ae��
��6��Na2S2O5��SԪ�صĻ��ϼ�Ϊ+4�ۣ���˻ᱻ����ΪΪ+6�ۣ��������ڿ������ױ�����ΪNa2SO4�������ᡢ�Ȼ�����Һ������Ʒ���Ƿ�����������ɣ�ʵ�鷽��Ϊ��ȡ����Na2S2O5�������Թ��У���������ˮ�ܽ⣬�μ����ᣬ���ٵμ��Ȼ�����Һ���а�ɫ�������ɣ��ʴ�Ϊ��ȡ����Na2S2O5�������Թ��У���������ˮ�ܽ⣬�μ����ᣬ���ٵμ��Ȼ�����Һ���а�ɫ�������ɡ�

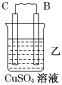
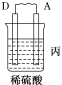
����Ŀ����A��B��C��D���ֽ������±���װ�ý���ʵ�顣
װ�� |
|
|
|
���� | ���۽���A�����ܽ� | C���������� | A����������� |
����ʵ������ش��������⣺
��1��װ�ü��и����ĵ缫��Ӧʽ��________________________________________��
��2��װ���ң�����·��ת��6.02��1022��e������C�����ӵ�����Ϊ ��
��3��װ�ñ�����Һ��pH________��������С�����䡱����
��4�����ֽ��������ǿ������˳����____________________________________��