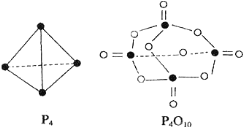
题目内容
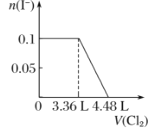
【题目】向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是( )
A. c=1000b/11.2V B. p=m+Vc/125
C. n=m+17Vc D. 5m/3<p<17m/9
【答案】C
【解析】
A、根据题意进行分析,得出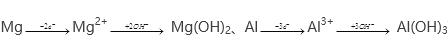 ,沉淀中OH-的物质的量为
,沉淀中OH-的物质的量为![]() mol,因为合金与硫酸是恰好完全反应,因此KOH中的OH-全部转化成沉淀中OH-,即有V×10-3×c=
mol,因为合金与硫酸是恰好完全反应,因此KOH中的OH-全部转化成沉淀中OH-,即有V×10-3×c= ![]() ,推出c=1000b/11.2Vmol·L-1,故A正确;B、灼烧后得到的固体为MgO和Al2O3,根据质量守恒,p=合金的质量+m(O)=m+m(O),m(O)=16n(O)=16m(O)=16n(O)=16[n(Mg)+3/2n(Al)]=8[2n(Mg)+3n(Al)],依据得失电子数目守恒以及选项A的分析,2n(Mg)+3n(Al)]=
,推出c=1000b/11.2Vmol·L-1,故A正确;B、灼烧后得到的固体为MgO和Al2O3,根据质量守恒,p=合金的质量+m(O)=m+m(O),m(O)=16n(O)=16m(O)=16n(O)=16[n(Mg)+3/2n(Al)]=8[2n(Mg)+3n(Al)],依据得失电子数目守恒以及选项A的分析,2n(Mg)+3n(Al)]=![]() =V×10-3×c,则p=m+Vc/125,故B正确;C、沉淀为Mg(OH)2和Al(OH)3,则沉淀质量n=合金质量+m(OH-)=m+17VC×10-3,故C错误;D、假设mg全部为镁,则MgO的质量为
=V×10-3×c,则p=m+Vc/125,故B正确;C、沉淀为Mg(OH)2和Al(OH)3,则沉淀质量n=合金质量+m(OH-)=m+17VC×10-3,故C错误;D、假设mg全部为镁,则MgO的质量为![]() g,假设全部是Al,则Al2O3的质量为
g,假设全部是Al,则Al2O3的质量为![]() ,则p的范围是5m/3<p<17m/9,故D正确。
,则p的范围是5m/3<p<17m/9,故D正确。

 名校课堂系列答案
名校课堂系列答案【题目】q电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×l0-7,K2=4.7×10-11 |
(1) 25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3 溶液、c.CH3COONa 溶液)的pH由大到小的顺序为__________________。(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2, 所发生反应的化学方程式为__________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+ )>c(CN-),下列关系正确的是__________________。
A. c(H+)>c(OH-) B.c(H+)-)
C. c(H+)+c(HCN)= C(OH-) D. c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析,HA 是强酸还是弱酸___________________。
②b组情况表明,C____0.2 (选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)___c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c (OH-)=___mol/L。写出该混合溶液中下列算式的精确结果(不需做近似计算)。c (Na+)-c(A-)=____mol/L。
(5)已知在100℃时,水的离子积为1×10-12,此时将pH=11 的NaOH溶液V1 L与pH=2的H2SO4溶液V2L均匀混合后,若所得混合溶液的pH=10,则V1:V2为_________。
(6)HA为弱酸,在室温下,用蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是____。
A.c(H+)/c(A-) B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值 E.水的电离程度