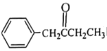
题目内容
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s) ![]() 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A. 平衡常数减小 B. BaO量不变
C. 氧气压强变大 D. BaO2量增加
【答案】D
【解析】
该反应是正向气体体积增大的反应,缩小容器容积反应逆向移动,据此分析;
A.温度不变平衡常数不变,故A项错误;
B.该反应是正向气体体积增大的反应,缩小容器容积反应逆向移动,BaO量减小,故B项错误;
C.温度不变,平衡常数不变,氧气的浓度不变,氧气的压强不变,故C项错误;
D.该反应是正向气体体积增大的反应,缩小容器容积反应逆向移动,BaO2量增加,故D项正确;
综上,本题选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】碱式碳酸钴用作催化剂及制钴盐原料,陶瓷工业着色剂,电子、磁性材料的添加剂。利用以下装置测定碱式碳酸钴[Cox(OH)y(CO3)z·H2O]的化学组成。

已知:碱式碳酸钴中钴为+2价,受热时可分解生成三种氧化物。请回答下列问题:
(1)选用以上装置测定碱式碳酸钴[Cox(OH)y(CO3)z·H2O]的化学组成,其正确的连接顺序为a→b→____(按气流方向,用小写字母表示)。
(2)样品分解完,打开活塞K,缓缓通入氮气数分钟,通入氮气的目的是_______________。
(3)取碱式碳酸钴样品34.9 g,通过实验测得分解生成的水和二氧化碳的质量分别为3.6 g、8.8 g,则该碱式碳酸钴的化学式为______________________________。
(4)某兴趣小组以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种实验设计流程如下:

已知:25 ℃时,部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 1.9 | 7.0 | 7.6 | 3.4 |
完全沉淀(pH) | 3.2 | 9.0 | 9.2 | 4.7 |
①操作Ⅰ用到的玻璃仪器主要有___________、_____________、___________;
②加盐酸调整pH为2~3的目的为____________________________________________;
③操作Ⅱ的过程为_______________、_______________、____________、洗涤、干燥。