题目内容
10.25℃时,0.05mol/LH2SO4溶液的pH=1; 0.05mol/LBa(OH)2溶液C(H+)=1×10-13mol/L,pH=13.分析 溶液中PH=-lgC(H+),H2SO4为二元强酸,溶液中氢离子浓度c(H+)=2c(H2SO4),Ba(OH)2为二元强碱,溶液中氢氧根离子浓度c(OH-)=2c(Ba(OH)2),碱溶液中先计算氢氧根离子浓度,再根据氢离子浓度与氢氧根离子浓度和离子积常数之间的关系式Kw=c(OH-)×c(H+)计算.
解答 解:25℃时:Kw=c(OH-)×c(H+)=10-14,0.05mol/LH2SO4溶液中氢离子浓度c(H+)=0.05 mol/L×2=0.1mol/L,pH=-lgc(H+)=-lg0.1=1;
0.05mol/LBa(OH)2溶液中氢氧根离子浓度=0.05 mol/L×2=0.1mol/L,根据离子积常数Kw=c(OH-)×c(H+)知,溶液中氢离子浓度c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=1×10-13 mol/L,所以溶液的PH=-lgC(H+)=13,
故答案为:1;1×10-13mol/L;13.
点评 本题考查了pH的有关计算,题目难度不大,明确氢离子浓度、氢氧根离子浓度和离子积常数之间的关系是解本题关键.

练习册系列答案
相关题目
20.下列各组离子在溶液中能大量共存的是( )
| A. | K+、H+、Cl-、OH- | B. | K+、H+、HCO3-、Cl- | ||
| C. | Fe2+、H+、Br-、OH- | D. | K+、NH4+、SO42-、Cl- |
15.将一定体积密度为1.3g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止.己知反应后所得溶液的质量等于原BaCl2溶液的质量,则原硫酸溶液浓度为( )
| A. | 33.9% | B. | 31.0% | C. | 6.65 mol/L | D. | 5.58 mol/L |
2.下列关于胶体的叙述不正确的是( )
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间 | |
| B. | 一束光线透过胶体时,胶体中可发生丁达尔效应 | |
| C. | 胶体的分散质粒子直径比溶液的大,故胶粒不能透过滤纸 | |
| D. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
19.可逆反应mA(g)+nB(g)?xC(g)+yD(g),能够改变反应速率,同时能使平衡一定发生移动的条件是( )
| A. | 浓度 | B. | 温度 | C. | 压强 | D. | 催化剂 |
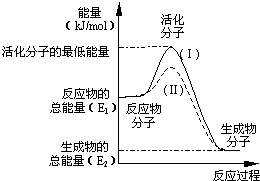 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题: .
.