题目内容
20.下列各组离子在溶液中能大量共存的是( )| A. | K+、H+、Cl-、OH- | B. | K+、H+、HCO3-、Cl- | ||
| C. | Fe2+、H+、Br-、OH- | D. | K+、NH4+、SO42-、Cl- |
分析 如离子之间不发生复分解、氧化还原反应、相互促进的水解反应以及络合反应,则离子能大量共存,反之不可共存,以此解答该题.
解答 解:A.H+、OH-反应生成水,不能大量共存,故A错误;
B.H+、HCO3-反应生成水、二氧化碳气体,不能大量共存,故B错误;
C.Fe2+、H+与OH-反应不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存问题,为高考常见题型,侧重于学生的分析能力的考查,题目难度不大,注意离子发生反应的条件以及常见离子反应的类型,注重相关基础知识的积累.

练习册系列答案
相关题目
10.已知反应:2CH3OH(g)?CH3OCH3(g)+H2O(g),某温度下的平衡常数为400.在此温度下,向密闭容器中加入一定量CH3OH,反应到5min时测得各组分的浓度如表所示:
(1)该反应在低温下(此时水为液态)能自发进行,则该反应的△H<0 (填“>”、“<”或“=”,下同).
(2)比较此时正、逆反应速率的大小:v正>v逆,理由是浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反应向正反应进行.
(3)前5min时,用CH3OCH3表示该反应的速率为0.12mol/(L.min).
(4)再过一段时间后,反应达到平衡状态.能判断该反应已达到化学平衡状态的依据是B(填字母).
A.容器中压强不变 B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O) D.c(CH3OCH3)=c (H2O)
(5)达到平衡状态时,CH3OH的转化率97.6%(计算结果保留到小数点后1位).
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
(2)比较此时正、逆反应速率的大小:v正>v逆,理由是浓度商Qc=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.36<K=400,反应向正反应进行.
(3)前5min时,用CH3OCH3表示该反应的速率为0.12mol/(L.min).
(4)再过一段时间后,反应达到平衡状态.能判断该反应已达到化学平衡状态的依据是B(填字母).
A.容器中压强不变 B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O) D.c(CH3OCH3)=c (H2O)
(5)达到平衡状态时,CH3OH的转化率97.6%(计算结果保留到小数点后1位).
11.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 11.2L NO2含氧原子数为NA | |
| B. | 标准状况下,14g CO所含质子数为7NA | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 25℃,101KPa条件下,1.4g N2的体积为1.12L |
8.设NA代表阿伏加德罗常数,下列说法中,正确的是( )
| A. | 标准状况下6.72L NH3的质量约为5.1g | |
| B. | 10g D216O分子中所含中子数为4NA | |
| C. | 2.3g金属钠全部变成钠离子失去的电子数目为0.2NA | |
| D. | 150mL1mol/L氯化钠溶液与50mL1mol/L AlCl3溶液中氯离子的物质的量浓度相等 |
5.下列物质中不能导电的是( )
| A. | NaCl水溶液 | B. | 盐酸 | C. | 铝 | D. | KOH固体 |
9.下列电离方程式中,不正确的是( )
| A. | NaHSO4=Na++H++SO42- | B. | Ba(OH)2=Ba2++2OH- | ||
| C. | CaCO3=Ca2++CO32- | D. | KHCO3=K++H++CO32- |
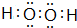 ;YW2分子形状为直线形.
;YW2分子形状为直线形.