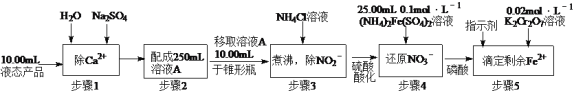
题目内容
【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
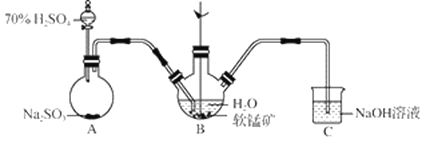
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
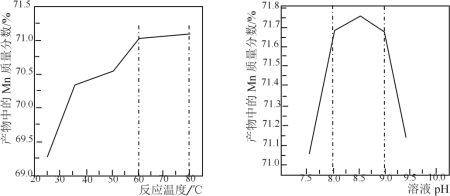
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
【答案】Na2SO3 + H2SO4 = Na2SO4+SO2↑+H2O 用90~100℃的水浴加热 吸收未反应的SO2 将Fe2+氧化为Fe3+ 4.9<pH<7.56 将滤液加热并保温在60~80℃,用氨水调节溶液pH并维持8~9,在不断搅拌下,边通空气边滴加氨水,至有大量黑色沉淀时,静置,在上层清液再滴加氨水至无沉淀,过滤,用去离子水洗涤沉淀直至过滤液中检不出SO42-
【解析】
(1)装置A制取SO2,发生的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)温度维持在90~100℃,适宜的加热方式为90~100℃的水浴加热;
(3)SO2有毒,污染空气,因此装置C的作用是吸收未反应的SO2;
(4)根据软锰矿中含有成分,以及表格中数据,MnO2作氧化剂,将Fe2+氧化成Fe3+,便于除去;加入MnCO3调节溶液的pH,使Fe3+、Al3+以氢氧化物的形式沉淀出来,但Mn2+不能沉淀出来,即调节的pH的范围是4.9≤pH<7.56;
(5)根据信息温度超过80℃,Mn3O4的产率开始降低,根据信息③,Mn3O4中Mn质量分数理论值为72.03℃,因此温度控制在60℃~80℃之间,根据pH与产物中Mn质量分数之间的关系,pH应控制在8~9之间,因此具体操作是将滤液加热并保温在60~80℃,用氨水调节溶液pH并维持8~9,在不断搅拌下,边通空气边滴加氨水,至有大量黑色沉淀时,静置,在上层清液再滴加氨水至无沉淀,过滤,用去离子水洗涤沉淀直至过滤液中检不出SO42-;

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】填写下列表格。
物质 | 分子数 | 质量 | 物质的量 | 摩尔质量 |
氮气 | _____ | 14 g | _____ | _____ |
硫酸 | 3.01×1022 | _____ | _____ | _____ |
水 | _____ | _____ | 0.5 mol | 18 g·mol-1 |