题目内容
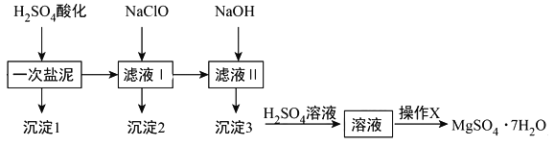
【题目】传感器可以检测空气中SO2的含量。传感器的工作原理如图所示,下列叙述正确的是( )
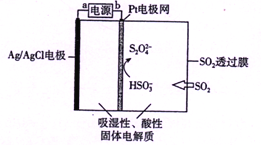
A. a为电源的负极
B. 负极的电极反应式:Ag-e-+Cl-= AgCl
C. 阴极的电极反应式:2HSO3-+2H++2e- = S2O42-+2H2O
D. 当电路中转移电子的物质的量为5×10-5mol时,进入传感器的SO2为1.12mL
【答案】C
【解析】试题分析:A、与b电极连接的电解池的电极上发生HSO3-变化为S2O42-,硫元素化合价降低发生还原反应,判断为阴极,b电极为原电池的负极,故A错误;B、与电源a极相连的电极为电解池的阳极,电极反应式 Ag-e-+Cl-═AgCl,故B错误;C、阴极的电极反应为HSO3-变化为S2O42-,依据电荷守恒和原子守恒书写电极反应为2HSO3-+2H++2e-═S2O42-+2H2O,故C正确;D、温度和压强不知不能计算气体体积,故D错误;故选C。

【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A | 小苏打受热易分解 | 焙制糕点 |
B | 蛋白质受热变性 | 高温杀死流感病毒 |
C | SO2具有漂白性 | 漂白滋补品银耳等食品 |
D | Al(OH)3分解吸收大量热量并有水生成 | 阻燃剂 |
A. A B. B C. C D. D
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
【实验一】配制并标定醋酸溶液的浓度。取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,然后用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所稀释的醋酸溶液的浓度进行标定。请回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液 的体积(mL) | 20.05 | 20.00 | 18.40 | 19.95 |
则①滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂 D.甲基橙)为指示剂(填字母)
②该醋酸溶液的准确浓度为________(保留小数点后四位)。
【实验二】探究浓度对醋酸电离程度的影响。用pH计测定25 ℃时不同浓度的醋酸溶液的pH,结果如下:
醋酸浓度 (mol·L-1) | 0.001 0 | 0.010 00 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是_________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度______(填“增大”“减小”或“不变”)。
【实验三】探究温度对醋酸电离程度的影响。
(5)要完成该探究,需要用pH计(或pH试纸)测定 ___________________________。
【醋酸电离的应用】
(6)通过实验测定常温下醋酸的Ka=1×10-5,则0.1 mol·L-1醋酸钠溶液的pH=________。