题目内容
【题目】“摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O] ![]() 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:
(1)铁元素在元素周期表中的位置为________,其价层电子排布图为________。
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为________。“摩尔盐”的分解产物中属于非极性分子的化合物是________。
(3)NH3的沸点比N2O的沸点________(填“高”或“低”),其主要原因是________。
(4)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中除了离子键以外还存在的化学键为________,与CN—互为等电子体的单质的分子式为_________。HCN分子中σ键和π键的个数之比为________。
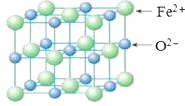
(5)FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为________,若该晶胞边长为acm,则该晶胞密度为________g/cm3。
【答案】 第四周期第Ⅷ族 ![]() N SO3 高 NH3分子间存在氢键 共价键和配位键 N2 1:1 6
N SO3 高 NH3分子间存在氢键 共价键和配位键 N2 1:1 6 ![]()
【解析】(1)铁的核电荷数为26,在元素周期表中的位置为第四周期第Ⅷ族,基态原子的电子排布式为[Ar]3d104s2,则其价层电子排布图为![]() ;
;
(2)组成“摩尔盐”的非金属元素中第一电离能最大的元素为________。“摩尔盐”的分解产物有Fe2O3、SO3、SO2、N2、NH3、H2O,其中SO3是平面结构,属于非极性分子,而N2是非极性分子单质,SO2、NH3、H2O均为极性分子;
(3)NH3分子间存在氢键,而N2O只存在范德华力,导致NH3的沸点比N2O的沸点高;
(4)K3[Fe(CN)6]中除了离子键以外,Fe2+与CN-形成配位键,CN-中存在C≡N键,为极性共价键,三键中有1个σ键2个π键,还存在共价键和配位键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2;HCN分子中存在H—C单键和C≡N,其中三键中有1个σ键2个π键,则HCN分子中σ键和π键的个数之比为2:2=1:1;
(5)以亚铁离子为中心,沿X、Y、Z三轴进行切割,结合图片知,亚铁离子配位数为6,该晶胞中亚铁离子个数=8×![]() +6×
+6×![]() =4,O离子个数=12×
=4,O离子个数=12×![]() +1=4,其密度=
+1=4,其密度= =
= g/cm3=
g/cm3=![]() g。
g。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
