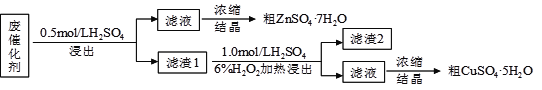题目内容
【题目】凤凰石是一种用于建材装饰的硅酸盐矿物,已知某地出产的凤凰石可看作由主要成分硅酸铜盐X·3H2O(摩尔质量=334g/mol)与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液Ⅱ中滴入KSCN溶液显血红色。

请回答:
(1)杂质Y中除氧以外还含有的元素为_____(填元素符号),x的化学式为_______。
(2)如果王溶液Ⅱ中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所导致,写出反应的离子方程式__________。
【答案】 Fe、C Cu2SiO6或2CuO·2SiO2 2Fe3++H2O2=2Fe2++2H++O2↑
【解析】试题分析:在溶液Ⅱ中滴入KSCN溶液显血红色,说明含有Fe3+;X、Y的混合物加入足量盐酸,生成二氧化碳,Y中除氧以外还含有的元素为Fe、C;X中含有Cu、Si、O元素,根据相对分子质量计算化学式;(2)Y中具有氧化性的只可能是Fe3+;
解析:(1)溶液Ⅱ中含有Fe3+;X是硅酸铜盐,X、Y的混合物加入足量盐酸,放出生成二氧化碳,所以Y中除氧以外还含有的元素为Fe、C,生成氯化铜的物质的量27g÷135 g/mol=0.2 mol;二氧化硅的物质的量12 g÷60 g/mol=0.2 mol,即 n(Cu):n(Si)=1:1,则x的化学式可表示为(CuO·SiO2)n,X·3H2O的摩尔质量334g/mol,X的摩尔质量280g/mol,n= 280÷140=2,x的化学式为2CuO·2SiO2;(2)Y中的Fe3+将H2O2氧化为氧气的离子方程式2Fe3++H2O2=2Fe2++2H++O2↑。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目