题目内容
【题目】已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为____________,属于___________分子(填“极性”或“非极性”),E的基态原子的外围电子排布式为____________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为____________。
(3)C元素形成含氧酸酸性强弱:HNO3____________HNO2(填“>”或“<”)NO3—的空间构型是___________,NO2—中心原子的杂化方式为___________
(4)下列叙述正确的是____________(填序号)。
A. M是极性分子,N是非极性分子
B. M和BD2分子中的中心原子均采用sp2杂化
C. N分子中含有6个σ键和1个大π键
D. BD2晶体的熔点、沸点都比二氧化硅晶体的低
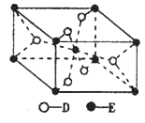
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示:
①Q(s)+2Cl2(g)=ECl4(l)+D2(g) △H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4和BD气体的热化学方程式:____________________
【答案】
(1)![]() ;极性;3d24s2;
;极性;3d24s2;
(2)C<O<N;
(3)>; 平面三角形;sp2 杂化;
(4)AD
(5)TiO2(s) +2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) △H=-81kJ/mol
【解析】
试题分析:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A是原子半径最小的元素,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布为1s22s22p2,故B为碳元素;D原子的核外成对电子数是未成对电子数的3倍,核外电子排布为1s22s22p4,故D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,该气体M为HCHO;A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为苯;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti。
(1)A2D2分子为H2O2,其电子式为![]() ,分子中电荷分布不均匀,属于极性分子;E为Ti,原子序数为22,其基态原子的外围电子排布式为3d24s2,故答案为:
,分子中电荷分布不均匀,属于极性分子;E为Ti,原子序数为22,其基态原子的外围电子排布式为3d24s2,故答案为:![]() ;极性;3d24s2;
;极性;3d24s2;
(2)同周期自左而右第一电离能增大,但N原子p轨道半满,为稳定状态,故第一电离能C<O<N,故答案为:C<O<N;
(3)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:HNO3>HNO2,NO3—中N原子的价层电子对数为3+![]() (5+1-2×3)=3,含有一个孤电子对,属于平面三角形,NO2—中N原子的价层电子对数为2+
(5+1-2×3)=3,含有一个孤电子对,属于平面三角形,NO2—中N原子的价层电子对数为2+![]() (5+1-2×2)=3,采取sp2杂化,故答案为:>; 平面三角形;sp2 杂化;
(5+1-2×2)=3,采取sp2杂化,故答案为:>; 平面三角形;sp2 杂化;
(4)A.HCHO中O氧原子电负性很大,是极性分子,N为苯,是非极性分子,故A正确;B.HCHO中C原子形成3个σ键,没有孤电子对,碳原子采用sp2杂化,二氧化碳分子为直线型结构,碳原子采用sp杂化,故B错误;C.苯分子中H-C之间是s-sp2形成的σ键,C-C之间是sp2形成的σ键,苯分子中含有12个σ键和1个大π键,故C错误;D.CO2属于分子晶体,二氧化硅属于原子晶体,二氧化碳的熔点、沸点都比二氧化硅晶体的低,故D正确,故选:AD;
(5)晶胞中Ti原子数目为1+8×![]() =2,氧原子数目为2+4×
=2,氧原子数目为2+4×![]() =4,故氧化物Q的化学式为TiO2,①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+140kJ/mol,②2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,根据盖斯定律,将①+②可得TiO2和焦炭、氯气反应生成液态TiCI4和CO气体的热化学方程式为2C(s)+TiO2(s)+2Cl2(g)=TiCl4(l)+2CO(g)△H=-81kJ/mol,故答案为:2C(s)+TiO2(s)+2Cl2(g)=TiCl4(l)+2CO(g) △H=-81kJ/mol。
=4,故氧化物Q的化学式为TiO2,①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+140kJ/mol,②2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,根据盖斯定律,将①+②可得TiO2和焦炭、氯气反应生成液态TiCI4和CO气体的热化学方程式为2C(s)+TiO2(s)+2Cl2(g)=TiCl4(l)+2CO(g)△H=-81kJ/mol,故答案为:2C(s)+TiO2(s)+2Cl2(g)=TiCl4(l)+2CO(g) △H=-81kJ/mol。

【题目】(1)已知反应 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g) ![]() H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
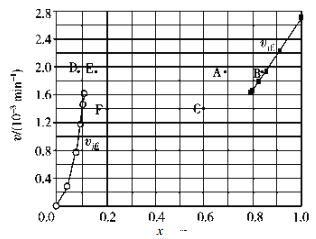
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。