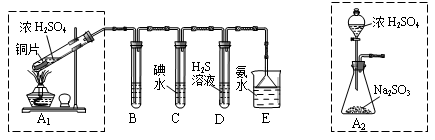
题目内容
研究发现,空气中少量的NO2能作为催化剂参与硫酸型酸雨的形成,NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是
| A.硫化氢通入浓H2SO4中 | B.稀H2SO4和乙酸乙酯共热 |
| C.浓H2SO4和C2H5OH共热到170℃ | D.潮湿的氯气通过盛有浓H2SO4的洗气瓶 |

 B
B选项A中浓硫酸是氧化剂,B中是催化剂,C中是催化剂和脱水剂,D中是吸水剂,因此正确的答案选B。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
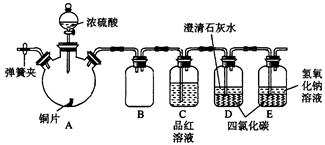
 Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是
Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是