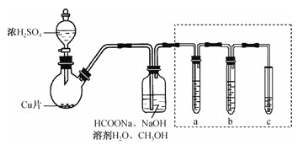
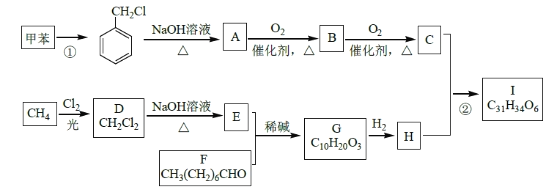
题目内容
【题目】一定条件下2L的密闭容器中,有反应2SO2(g)+O2(g)![]() 2SO3(g)+Q。
2SO3(g)+Q。
(1)若起始时SO2为2mol,反应2min后SO2剩余1.6mol,则在0~2min内SO2的平均反应速率为_____mol/(L·min);若继续反应使SO2剩余1.2mol,则需要再反应的时间_____2min(不考虑温度变化);(选填“>”、“<”或“=”)
(2)反应达到平衡后,在其他条件不变的情况下,升高温度,下列说法正确的是_____;(选填字母)
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
(3)若反应速率(v)与时间(t)的关系如图所示,则导致t1时刻速率发生变化的原因可能是_____;(选填字母)

A.增大A的浓度 B.缩小容器体积
C.加入催化剂 D.降低温度
(4)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)。下列说法错误的是_____。(选填字母)
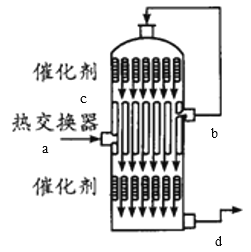
A.a、b两处的混合气体成分相同,b处气体温度高
B.c、d两处的混合气体成分不同
C.热交换器的作用是预热待反应的气体,冷却反应后的气体
D.反应气体进行两次催化氧化的目的是提高SO2的转化率
(5)硫酸工业制法中硫铁矿是制取SO2的主要原料。硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO2 4FeS2+11O2→2Fe2O3+8SO2,若48molFeS2完全反应耗用氧气131 mol,则反应产物中Fe3O4与Fe2O3物质的量之比为________。
【答案】0.1 > C B B 2:9
【解析】
(1) 根据反应速率的公式计算;
(2)升高温度正反应和逆反应速率都增大,又因为反应2SO2(g)+O2(g)![]() 2SO3(g)是放热反应,升高温度反应逆向移动;
2SO3(g)是放热反应,升高温度反应逆向移动;
(3)由图可知,t1时正反应和逆反应速率都增大,并且v(正)大于v(逆),说明反应正向移动。
(4) A.从a进入的气体是含有SO2、O2、N2等的冷气,经过热交换器后从b处出来的是热的气体;
B.在c处出来的气体SO2、O2在催化剂表面发生反应产生的含有SO3及未反应的SO2、O2等气体,该反应是放热反应,当经过热交换器后被冷的气体降温,SO3变为液态;
C.热交换器的作用是预热待反应的冷的气体,同时冷却反应产生的气体,为SO3的吸收创造条件;
D.使未反应的SO2进一步反应产生SO3,从而可以提高SO2的转化率;
(5)根据铁元素和氧元素守恒计算。
(1) 0~2min内SO2的平均反应速率为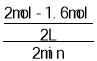 =0.1 mol/(L·min);反应过程中SO2的浓度降低,反应速率减慢,若继续反应使SO2剩余1.2mol,则需要再反应的时间>2min;
=0.1 mol/(L·min);反应过程中SO2的浓度降低,反应速率减慢,若继续反应使SO2剩余1.2mol,则需要再反应的时间>2min;
(2)升高温度正反应和逆反应速率都增大,又因为反应2SO2(g)+O2(g)![]() 2SO3(g)是放热反应,升高温度反应逆向移动,故选C;
2SO3(g)是放热反应,升高温度反应逆向移动,故选C;
(3)由图可知,t1时正反应和逆反应速率都增大,并且v(正)大于v(逆),说明反应正向移动,反应2SO2(g)+O2(g)![]() 2SO3(g)是气体体积减少的反应,可以通过缩小容器体积而增大压强实现,催化剂不改变反应进程,降低温度反应速率减小,故选B。
2SO3(g)是气体体积减少的反应,可以通过缩小容器体积而增大压强实现,催化剂不改变反应进程,降低温度反应速率减小,故选B。
(4) A.根据装置图可知,从a进入的气体是含有SO2、O2、N2等的冷气,经过热交换器后从b处出来的是热的气体,成分与a处相同,故A正确;
B.在c处出来的气体有SO2、O2和在催化剂表面发生反应产生的SO3,该反应是放热反应,经过热交换器时,把反应产生的热量传递给从a口进入的原料气,在下层催化剂处再次发生催化氧化,从d口出去的气体主要是生成的SO3及未反应的少量的SO2、O2等气体,故二者含有的气体的成分相同,故B错误;
C.热交换器的作用是预热待反应的冷的气体,同时冷却反应产生的气体,为SO3的吸收创造条件,故C正确;
D.处气体经过热交换器后再次被催化氧化,目的就是使未反应的SO2进一步反应产生SO3,从而可以提高SO2的转化率,故D正确;
故选:B。
(5)设反应产物中Fe3O4的物质的量为xmol,Fe2O3的物质的量为ymol,根据铁元素守恒有:3x+2y=48,根据消耗氧气的量有:8x+5.5y=131,解得:x=4mol,y=18mol,则则反应产物中Fe3O4与Fe2O3物质的量之比为2:9。

【题目】根据下列实验操作和现象所得到的结论正确的是![]()
![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 向足量含KSCN的 | 溶液变黄 | 还原性:Fe2+>Br- |
B | 向2mL浓度为 | 开始出现白色沉淀,后出现黄色沉淀 |
|
C | 取等质量的Al和Fe,分别与足量的稀硫酸反应 | Al产生的氢气多 | 金属性: |
D | 向苯酚浊液中滴加饱和 | 浊液变澄清 | 酸性:苯酚 |
A.AB.B/span>C.CD.D