题目内容
【题目】工业合成氨与制备硝酸一般可连续生产,流程如下:


(1)在合成氨的反应中,改变反应条件,会使平衡发生移动。如下图像表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号)_________,当横坐标为温度时,变化趋势正确的是(选填字母序号)_________。
(2)如图所示三个容积相同的容器①、②、③,若起始温度相同,
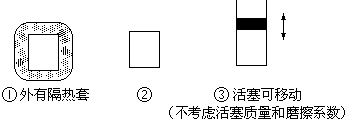
分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,达到平衡时各容器中NH3物质的百分含量由小到大的顺序为(填容器编号)________________。
【答案】(1) b(2分) a(2分) (2)①<②<③(2分)
【解析】
试题分析:(1)工业合成氨为N2+3H2![]() 2NH3 △H<0 增大压强时平衡向右进行,氨气的百分含量增大,答案选b;因△H<0,为放热反应,升高温度,平衡向逆反应方向移动,氨气的百分含量减少,答案选a;
2NH3 △H<0 增大压强时平衡向右进行,氨气的百分含量增大,答案选b;因△H<0,为放热反应,升高温度,平衡向逆反应方向移动,氨气的百分含量减少,答案选a;
(2)以②为基准,①外有隔热套,相当于在②基础上加热平衡向逆反应方向移动,氨气的百分含量减少。③是恒压状态,相当于在②基础上加压,平衡向右进行,氨气的百分含量增大,所以NH3物质的百分含量由大到小的顺序为①<②<③。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
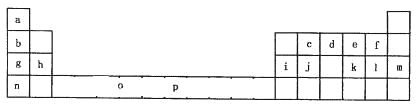
试回答下列问题:
(1)元素p为26号元素,请画出其基态原子外围电子排布图______________;
(2)e与a反应的产物的分子中中心原子的杂化形式为________________;该分子是_________(填“极性”或“非极性”)分子。
(3)上表中元素基态原子的第一电离最大的元素是__________。(用元素符号表示)
(4)o、p两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难,对此,你的解释是______________;



